
Wetenschap
Hoe kunt u 18 mmol kopersulfaattetrahydraat voorbereiden?
1. Bereken de benodigde massa:
* Molaire massa van Cuso₄ · 4h₂o:
* Cu:63,55 g/mol
* S:32.06 g/mol
* O:16,00 g/mol (x 9 totale zuurstofatomen)
* H:1,01 g/mol (x 8 totale waterstofatomen)
* Totale molaire massa:249,69 g/mol
* Mass nodig:
* 18 mmol * (249,69 g/mol)/(1000 mmol/mol) =4,49 g
2. Weeg het kopersulfaattetrahydraat af:
* Gebruik een balans om zorgvuldig 4,49 g kopersulfaattetrahydraat te wegen.
3. Los op in water:
* Voeg het gewogen kopersulfaattetrahydraat toe aan een geschikte container (bijv. Een beker of volumetrische kolf).
* Voeg gedestilleerd water toe om de vaste stof volledig op te lossen.
* Het exacte volume water hangt af van de gewenste concentratie. Als u een specifieke concentratie wilt, moet u het benodigde volume water berekenen op basis van het uiteindelijke gewenste volume.
belangrijke opmerkingen:
* zuiverheid: Gebruik altijd analytische kwaliteit kopersulfaattetrahydraat voor nauwkeurige resultaten.
* Veiligheid: Kopersulfaat is irriterend. Draag de juiste veiligheidsbril en handschoenen bij het hanteren.
* Oplosbaarheid: Kopersulfaattetrahydraat is zeer oplosbaar in water. Zorg ervoor dat het watervolume voldoende is voor volledige oplossing.
* concentratie: Als u een specifieke concentratie van kopersulfaatoplossing nodig hebt, moet u het uiteindelijke volume water berekenen dat nodig is.
Voorbeeld:een oplossing van 0,1 m maken:
* Gewenst volume: Stel dat u 100 ml van een oplossing van 0,1 M wilt.
* mol cuso₄ · 4h₂o nodig: 0,1 mol/L * 0,1 L =0,01 mol
* Massa van Cuso₄ · 4h₂o nodig: 0,01 mol * 249,69 g/mol =2,497 g
* Los de 2.497 g in water op en breng het uiteindelijke volume tot 100 ml.
Laat het me weten als je nog meer vragen hebt over het maken van een specifieke concentratie van kopersulfaatoplossing!
 Nieuwe manier om naar celmembranen te kijken, kan de manier veranderen waarop we ziekten bestuderen
Nieuwe manier om naar celmembranen te kijken, kan de manier veranderen waarop we ziekten bestuderen Wat geeft geel op de pH -schaal aan?
Wat geeft geel op de pH -schaal aan?  Nieuwe methode brengt chemicaliën in de huid in kaart
Nieuwe methode brengt chemicaliën in de huid in kaart Is Inconel compatibel met zoutzuur?
Is Inconel compatibel met zoutzuur?  Chemische reacties kunnen zowel kwantuminformatie als zwarte gaten door elkaar gooien
Chemische reacties kunnen zowel kwantuminformatie als zwarte gaten door elkaar gooien
 Giftige PAK-luchtverontreinigende stoffen uit fossiele brandstoffen vermenigvuldigen zich in zonlicht
Giftige PAK-luchtverontreinigende stoffen uit fossiele brandstoffen vermenigvuldigen zich in zonlicht Studie voorspelt significante stranderosie in Zuid-Californië
Studie voorspelt significante stranderosie in Zuid-Californië Wat gebeurt er als het Kyoto-protocol afloopt?
Wat gebeurt er als het Kyoto-protocol afloopt?  Honderden oude grondwerken gebouwd in de Amazone
Honderden oude grondwerken gebouwd in de Amazone De toekomst te rooskleurig maken:hoe wensdenken ons in de verkeerde richting kan wijzen
De toekomst te rooskleurig maken:hoe wensdenken ons in de verkeerde richting kan wijzen
Hoofdlijnen
- Wat is het forumla voor fotosynthese?
- De methoden van inventarisatie in Microbes
- Wat maakt eiwitten driedimensionaal?
- Biologen ontdekken genetische routes die het immuunsysteem en de bloedsomloop van muggen tijdens infectie met elkaar verbinden
- Voordelen en nadelen van klonen
- Hoe beïnvloedt een organellenstructuur de functie?
- Als deze tanden konden praten:wat stond er werkelijk op het menu van onze voorouders?
- Is sommige microorgamisme beter bestand tegen hitte dan anderen?
- Hoe fruitvliegen hun omgeving opsnuiven
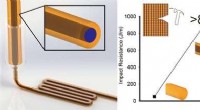
- Samenwerking zorgt voor doorbraak in duurzame elektronicaproductie

- Nieuwe studie onthult computergestuurde benadering voor het onderdrukken van kankertumorgroei
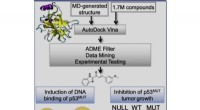
- Studie effent de weg voor nieuwe lichtgevoelige materialen

- 3D-printen van plastic onderdelen verbeteren
- Tubuline-remmer met een uniek moleculair werkingsmechanisme

 Hardy wetenschappers trekken te midden van chaos naar de laatste gletsjer van Venezuela
Hardy wetenschappers trekken te midden van chaos naar de laatste gletsjer van Venezuela Wat is Mazda 13b as rotatie richting?
Wat is Mazda 13b as rotatie richting?  Nieuwe theorie suggereert dat zware elementen ontstaan wanneer oerzwarte gaten neutronensterren van binnenuit opeten
Nieuwe theorie suggereert dat zware elementen ontstaan wanneer oerzwarte gaten neutronensterren van binnenuit opeten Vormprogrammeerbare diëlektrische actuatoren van vloeibaar kristalelastomeer
Vormprogrammeerbare diëlektrische actuatoren van vloeibaar kristalelastomeer Aandelenmarkten raken steeds meer verbonden door hoogfrequente handelaren
Aandelenmarkten raken steeds meer verbonden door hoogfrequente handelaren Rechters lijken klaar om te beslissen tegen Microsoft in e-mailzaak
Rechters lijken klaar om te beslissen tegen Microsoft in e-mailzaak Waarom is puur water een niet -elektrolyt?
Waarom is puur water een niet -elektrolyt?  Wat is Siesmic?
Wat is Siesmic?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

