
Wetenschap
Hoe kunt u de dampdruk van water berekenen over oplossing bij 90 graden Celsius is 525,8 mmHg?
Dit is waarom:
* dampdruk van een oplossing hangt af van de opgeloste stof: De dampdruk van een oplossing is * lager * dan de dampdruk van het zuivere oplosmiddel (in dit geval water). Deze verlaging is direct gerelateerd aan de concentratie van de opgeloste stof in de oplossing.
* U hebt informatie nodig over de opgeloste stof: Om de dampdruk van de oplossing te berekenen, moet u weten:
* De identiteit van de opgeloste stof: Verschillende opgeloste stoffen hebben verschillende effecten op dampdruk.
* De concentratie van de opgeloste stof: Hoe meer geconcentreerd de oplossing, hoe lager de dampdruk.
hoe dampdruk te berekenen:
1. Raoult's wet: Deze wet stelt dat de partiële druk van een oplosmiddel boven een oplossing gelijk is aan de molfractie van het oplosmiddel vermenigvuldigd door de dampdruk van het zuivere oplosmiddel.
* P oplossing =X oplosmiddel * P oplosmiddel
* Waar:
* P oplossing =Dampdruk van de oplossing
* X oplosmiddel =Mol fractie van het oplosmiddel
* P oplosmiddel
2. Zoek de molfractie:
* Je moet de mol oplosmiddelen en opgeloste stof in de oplossing kennen.
3. Gebruik de bekende dampdruk van zuiver water bij 90 ° C:
* U moet de dampdruk van zuiver water vinden bij 90 ° C. Deze waarde is te vinden in tabellen of online.
Voorbeeld:
Laten we zeggen dat u een oplossing van suiker (opgeloste stof) in water (oplosmiddel) hebt bij 90 ° C. U weet dat de dampdruk van de oplossing 525,8 mmHg is en u wilt de molfractie water in de oplossing vinden.
1. Vind de dampdruk van zuiver water bij 90 ° C:
* Dit is ongeveer 525,8 mmHg (u gaf dit als de dampdruk van de oplossing, die ongebruikelijk is; meestal is de oplossingdampdruk * lager * dan het zuivere oplosmiddel).
2. Gebruik de wet van Raoult:
* 525,8 mmhg =x water * 525,8 mmHg
* X water =1
In dit specifieke voorbeeld lijkt het erop dat de oplossing in wezen zuiver water is, omdat de dampdruk van de oplossing dezelfde is als de dampdruk van zuiver water bij 90 ° C. Dit is een zeer ongebruikelijk scenario in de chemie, maar het illustreert het concept van het berekenen van dampdruk.
Laat het me weten als u meer informatie over de oplossing hebt en ik kan u helpen de dampdruk te berekenen.
 Wat is de functie van rond bodemkolf?
Wat is de functie van rond bodemkolf?  Hoe maakt zout water een eierdipper?
Hoe maakt zout water een eierdipper?  Onderzoekers visualiseren direct producten van wederzijdse neutralisatie van hydronium en hydroxide
Onderzoekers visualiseren direct producten van wederzijdse neutralisatie van hydronium en hydroxide  Onderzoekers maken apparaat om risico's voor borstkanker te identificeren
Onderzoekers maken apparaat om risico's voor borstkanker te identificeren Wat is het verschil tussen een homogeen en heterogeen mengsel?
Wat is het verschil tussen een homogeen en heterogeen mengsel?
 Hoe binnenwateren koolstof ‘inademen’ – en wat dit betekent voor mondiale systemen
Hoe binnenwateren koolstof ‘inademen’ – en wat dit betekent voor mondiale systemen  Kunstmatige intelligentie gebruiken om koraalriffen te redden
Kunstmatige intelligentie gebruiken om koraalriffen te redden Buren van Seattle werken samen tegen ontwikkelaar om uitzonderlijke boom te redden
Buren van Seattle werken samen tegen ontwikkelaar om uitzonderlijke boom te redden De onbedoelde gevolgen van dammen en reservoirs
De onbedoelde gevolgen van dammen en reservoirs Wereldwijde klimaatdoelstelling zou jaarlijks zes miljoen ton extra vis kunnen opleveren
Wereldwijde klimaatdoelstelling zou jaarlijks zes miljoen ton extra vis kunnen opleveren
Hoofdlijnen
- Pando in stukken:inzicht in de nieuwe breuk in 's werelds grootste levende wezen
- De zwaarste schildpad ter wereld? Overlevende van 8 keert terug naar oceaan
- De ziekte is gemakkelijker te verspreiden in de samenleving?
- Welk embryonaal weefsel maakt alle bindweefsel?
- Hoe krijgen mensen stikstof in hun lichaam?
- Kill-schakelaars voor gemanipuleerde microben die schurkenstaten zijn geworden
- Stamcellen die vetweefsel genereren, hebben een circadiane klok
- Wat is er met androgyn gebeurd?
- Wat is biologische paraatheid?
- Een revolutionair materiaal voor ruimtevaart en neuromorfisch computergebruik

- Hoe spinnenzijde ooit zou kunnen worden gebruikt bij de behandeling van kanker

- Nieuwe antibacteriële geneesmiddelen ontwikkeld aan de Universiteit van Oost-Finland
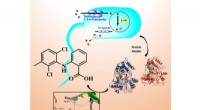
- Op algen geïnspireerde polymeren verlichten de weg voor verbeterd nachtzicht
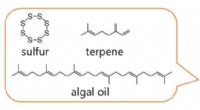
- Vormverschuivend materiaal kan morphen, keert zichzelf om met behulp van warmte, licht

 Overdracht van een domeinpatroon tussen magnetisatie en elektrische polarisatieruimte voor het eerst bereikt
Overdracht van een domeinpatroon tussen magnetisatie en elektrische polarisatieruimte voor het eerst bereikt Dubbele dosis algebra loont op de universiteit als studenten worden gekoppeld aan behulpzame leeftijdsgenoten
Dubbele dosis algebra loont op de universiteit als studenten worden gekoppeld aan behulpzame leeftijdsgenoten Wat trekt bloemen aan?
Wat trekt bloemen aan?  Komt de zwaartekracht die ons naar de aarde trekt van de zon?
Komt de zwaartekracht die ons naar de aarde trekt van de zon?  Wetenschappers modelleren het interieur van Saturnus
Wetenschappers modelleren het interieur van Saturnus Hoeveel land dekte gletsjers?
Hoeveel land dekte gletsjers?  WTF, wanneer leren wetenschappers minder acroniemen te gebruiken?
WTF, wanneer leren wetenschappers minder acroniemen te gebruiken? Wetenschappers bedenken duurzame, bijna-infrarood-emitterend materiaal
Wetenschappers bedenken duurzame, bijna-infrarood-emitterend materiaal
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

