
Wetenschap
Wat is een verbinding die veranderingen in de pH minimaliseert door ionen omkeerbaar in te nemen of uit te brengen?
Dit is waarom:
* buffers weerstaan veranderingen in pH: Ze doen dit door toegevoegde zuren of basen te neutraliseren.
* omkeerbaarheid: Buffers kunnen protonen (H+) doneren wanneer een basis wordt toegevoegd of protonen accepteren wanneer een zuur wordt toegevoegd. Met dit omkeerbare proces kunnen ze een relatief stabiel pH -bereik handhaven.
Voorbeelden van buffers:
* Bicarbonaatbuffersysteem: Gevonden in bloed gebruikt dit systeem bicarbonaationen (HCO3-) en carboninezuur (H2CO3) om pH te handhaven.
* fosfaatbuffersysteem: Belangrijk bij intracellulaire vloeistoffen, gebruikt het dihydrogen fosfaat (H2PO4-) en monohydrogen fosfaat (HPO42-) ionen.
* Tris -buffer: Een veelgebruikte laboratoriumbuffer, Tris (Tris (hydroxymethyl) aminomethaan) wordt vaak gebruikt voor biologische experimenten.
Key Concepts:
* Buffercapaciteit: De hoeveelheid zuur of base die een buffer kan neutraliseren voordat de pH aanzienlijk verandert.
* PKA: De pH waarbij een buffer het meest effectief is. De PKA is een kenmerk van het buffersysteem en geeft de pH aan waarbij de buffer half-geïoniseerd en half geprotoneerd is.
Laat het me weten als je een van deze aspecten verder wilt verkennen!
 Als een solide stuk naftaleen wordt verwarmd en op 80 graden Celsius blijft totdat het volledig is gesmolten, weet je dat dat is?
Als een solide stuk naftaleen wordt verwarmd en op 80 graden Celsius blijft totdat het volledig is gesmolten, weet je dat dat is?  Warmtebehandeling kan chemotherapie effectiever maken
Warmtebehandeling kan chemotherapie effectiever maken Hoeveel elektronen bevinden zich in de buitenste schil van een atoom met 15 elektronen?
Hoeveel elektronen bevinden zich in de buitenste schil van een atoom met 15 elektronen?  Hoe verschillen atorvastatine kristallijn van amorfe?
Hoe verschillen atorvastatine kristallijn van amorfe?  Kunnen alle soorten verbindingen worden gezuiverd door geactiveerde koolstof?
Kunnen alle soorten verbindingen worden gezuiverd door geactiveerde koolstof?
 Aanpak van plasticvervuiling voor gemeenschappen en koraalriffen aan de kust van Cambodja
Aanpak van plasticvervuiling voor gemeenschappen en koraalriffen aan de kust van Cambodja Experts berekenen toekomstig ijsverlies en bijdragen op zeeniveau van Groenland en Antarctica
Experts berekenen toekomstig ijsverlies en bijdragen op zeeniveau van Groenland en Antarctica Explosies rocken overstromingsverlamde chemische fabriek in de buurt van Houston
Explosies rocken overstromingsverlamde chemische fabriek in de buurt van Houston Waarom de vroeg-Polynesische nederzetting van Aotearoa Nieuw-Zeeland erkend moet worden met de status Werelderfgoed
Waarom de vroeg-Polynesische nederzetting van Aotearoa Nieuw-Zeeland erkend moet worden met de status Werelderfgoed Studie vindt diepe ondergrondse verbinding tussen twee Japanse vulkanen
Studie vindt diepe ondergrondse verbinding tussen twee Japanse vulkanen
Hoofdlijnen
- Triest afscheid als de in Maleisië geboren panda naar China gaat
- Hoe een model te maken Plant & Dierlijke cel
- Waarom produceert kernsplijting peervormige kernen?
- Wat is het verschil tussen Ribosoom en Ribosomaal DNA?
- Hoe biologische landbouw werkt
- Wat voor soort gewervelde is de olifant?
- Is de fysieke verschijning van een organisme het?
- Is een cattail eencellig of meercellulair?
- De majestueuze orchidee uit Singapore genoemd ter ere van koningin Elizabeth
- Nieuwe aanpak om peptidestapeling algemeen beschikbaar te maken
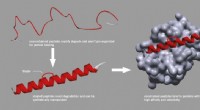
- Onderzoekers ontwikkelen selectieve elektrokatalysatoren om de prestaties van directe methanol-brandstofcellen te verbeteren
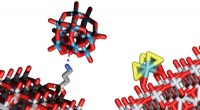
- Licht in plaats van elektriciteit:een nieuw soort groene waterstof
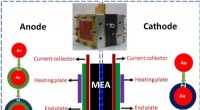
- Studie suggereert route naar verbetering oplaadbare lithiumbatterijen

- Onderzoekers 3D printen eerste hoogwaardige nanogestructureerde legering die zowel ultrasterk als ductiel is

 Nieuwe inzichten over hoe de vogelgriep de soortbarrière overschrijdt
Nieuwe inzichten over hoe de vogelgriep de soortbarrière overschrijdt  Ervaren dieren geluk?
Ervaren dieren geluk?  Bacteriën kunnen reizen tussen aarde en Mars overleven bij het vormen van aggregaten
Bacteriën kunnen reizen tussen aarde en Mars overleven bij het vormen van aggregaten Hoe verklaart u het belang van standaardeenheden?
Hoe verklaart u het belang van standaardeenheden?  Strengere emissielimieten schokken Europese auto-industrie
Strengere emissielimieten schokken Europese auto-industrie Zachte bollen nestelen zich in een enigszins verrassende structuur
Zachte bollen nestelen zich in een enigszins verrassende structuur  Welke invloed heeft het klimaat op het ecosysteem van het regenwoud?
Welke invloed heeft het klimaat op het ecosysteem van het regenwoud?  Kunnen mineralen neerslaan als vloeistoffen afkoelen of verdampen?
Kunnen mineralen neerslaan als vloeistoffen afkoelen of verdampen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

