
Wetenschap
Warmtebehandeling kan chemotherapie effectiever maken
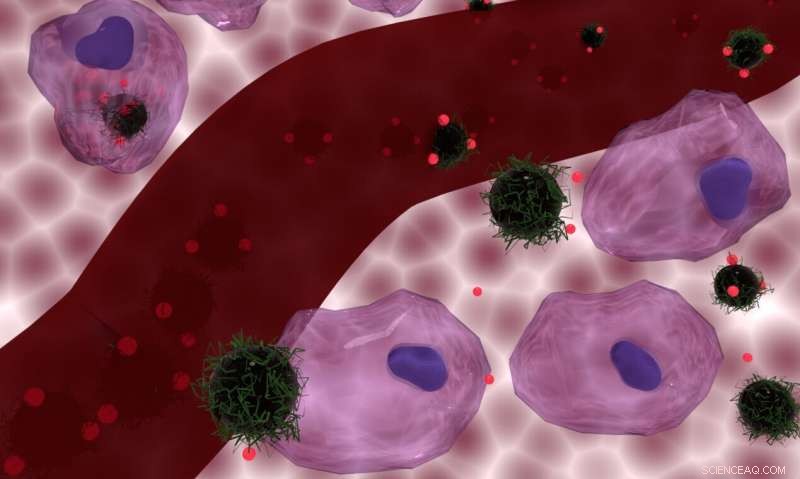
Een artistiek concept van de met doxorubicine beladen nanocomposietdragers die worden geïnternaliseerd door cellen (bovenaan) en overblijvende buitencellen (onderaan), met een bloedvat in het midden. Credit: Tijdschrift voor materiaalchemie B / Nguyen T.K. Thanh / Florian Aubrit / Olivier Sandre / Lilin Wang
Het opwarmen van kankercellen terwijl je ze met chemotherapie aanvalt, is een zeer effectieve manier om ze te doden. volgens een nieuwe studie onder leiding van UCL-onderzoekers.
De studie, gepubliceerd in de Journal of Materials Chemistry B , ontdekte dat het 'laden' van een chemotherapiemedicijn op kleine magnetische deeltjes die de kankercellen kunnen opwarmen en tegelijkertijd het medicijn aan hen afleveren, tot 34% effectiever was in het vernietigen van de kankercellen dan het chemotherapiemedicijn zonder toegevoegde warmte.
De magnetische ijzeroxide-nanodeeltjes die het chemotherapie-medicijn dragen, geven warmte af wanneer ze worden blootgesteld aan een wisselend magnetisch veld. Dit betekent dat, zodra de nanodeeltjes zich in het tumorgebied hebben opgehoopt, een wisselend magnetisch veld kan van buiten het lichaam worden aangelegd, waardoor warmte en chemotherapie gelijktijdig kunnen worden afgegeven.
De effecten van de twee behandelingen waren synergetisch, dat wil zeggen, elke behandeling verbeterde de effectiviteit van de andere, wat betekent dat ze krachtiger waren wanneer ze werden gecombineerd dan wanneer ze afzonderlijk waren. De studie werd uitgevoerd op cellen in een laboratorium en verder onderzoek is nodig voorafgaand aan klinische proeven waarbij patiënten betrokken zijn.
Senior auteur professor Nguyen T.K. Thanh (Biophysics Group, UCL Physics &Astronomy) zei:"Onze studie toont het enorme potentieel aan van het combineren van chemotherapie met warmtebehandeling via magnetische nanodeeltjes.
"Hoewel deze combinatie van therapie al is goedgekeurd voor de behandeling van snelgroeiende glioblastomen, onze resultaten suggereren dat het potentieel heeft om op grotere schaal te worden gebruikt als een brede antikankertherapie.
"Deze therapie heeft ook het potentieel om de bijwerkingen van chemotherapie te verminderen, door ervoor te zorgen dat het meer gericht is op kankercellen dan op gezond weefsel. Dit moet in verdere preklinische tests worden onderzocht."
In de studie, onderzoekers combineerden de magnetische nanodeeltjes met een veelgebruikt medicijn voor chemotherapie, doxorubicine, en vergeleek de effecten van dit composiet in verschillende scenario's op menselijke borstkankercellen, glioblastoom (hersenkanker) cellen, en muis prostaatkankercellen.
In het meest succesvolle scenario ze ontdekten dat hitte en doxorubicine samen na 48 uur 98% van de hersenkankercellen doodden, wanneer doxorubicine zonder warmte 73% doodde. In de tussentijd, voor de borstkankercellen, 89% werd gedood door hitte en doxorubicine samen, terwijl 77% na 48 uur werd gedood door alleen doxorubicine.
Kankercellen zijn gevoeliger voor hitte dan gezonde cellen - ze ondergaan een langzame dood (apoptose) zodra de temperatuur 42 graden Celsius bereikt, terwijl gezonde cellen temperaturen tot 45 graden Celsius kunnen weerstaan.
De onderzoekers ontdekten dat het verwarmen van kankercellen met slechts enkele graden, tot 40 graden Celsius, verbeterde de effectiviteit van de chemotherapie, wat betekent dat de behandeling effectief kan zijn met lagere doses nanodeeltjes.
Ze ontdekten dat de combinatie van therapieën het meest effectief was wanneer de nanodeeltjes werden geabsorbeerd, of geïnternaliseerd, door de kankercellen, maar ze ontdekten dat de chemotherapie ook werd versterkt wanneer de nanodeeltjes warmte afgeven terwijl ze buiten de kankercellen bleven (wat een gemakkelijkere vorm van behandeling zou zijn). Echter, de effecten bij lagere temperaturen traden alleen op wanneer de ijzeroxide-nanodeeltjes werden geïnternaliseerd of stevig op het oppervlak van de kankercellen werden afgezet.
De nanodeeltjes hebben ook een polymeercoating die voorkomt dat het chemotherapiemedicijn uitloogt in gezond weefsel. De coating is hitte- en pH-gevoelig, en is ontworpen om het medicijn af te geven wanneer de temperatuur stijgt en de nanodeeltjes worden geïnternaliseerd in kleine zakjes in cellen die "lysosomen" worden genoemd. die een lagere pH hebben dan de rest van het celmedium. Deze intracellulaire afgifte van het medicijn was vooral effectief voor de prostaatkankercellen van muizen, die een superieur en synergetisch celdoodeffect vertoonden, vooral toen de temperatuur 42°C bereikte.
Co-auteur Dr. Olivier Sandre, van de Universiteit van Bordeaux, zei:"Omdat warmte kan worden gegenereerd door het wisselende magnetische veld, de afgifte van het medicijn kan sterk gelokaliseerd zijn in kankercellen, mogelijk bijwerkingen verminderen."
 Nieuwe theorie voor hoe sneeuwvlokken groeien
Nieuwe theorie voor hoe sneeuwvlokken groeien Ultraheldere röntgenstralen onthullen de moleculaire structuur van membranen die worden gebruikt om zeewater te ontzilten
Ultraheldere röntgenstralen onthullen de moleculaire structuur van membranen die worden gebruikt om zeewater te ontzilten Molecuulstudies onthullen mogelijke behandeling voor patiënten met een beroerte
Molecuulstudies onthullen mogelijke behandeling voor patiënten met een beroerte Bluetooth-apparaat detecteert het fermentatieproces gedurende dagen
Bluetooth-apparaat detecteert het fermentatieproces gedurende dagen Wat zijn de effecten van antivries op het milieu?
Wat zijn de effecten van antivries op het milieu?
 Meerdere ecocrises kunnen leiden tot systemische ineenstorting:wetenschappers
Meerdere ecocrises kunnen leiden tot systemische ineenstorting:wetenschappers Menselijk afvalwater waardevol voor de wereldwijde landbouw, economie, studie vondsten
Menselijk afvalwater waardevol voor de wereldwijde landbouw, economie, studie vondsten Model suggereert dat goed ontworpen subsidies boeren kunnen helpen en consumenten betere voedselkeuzes kunnen geven
Model suggereert dat goed ontworpen subsidies boeren kunnen helpen en consumenten betere voedselkeuzes kunnen geven Soorten fossiele conservering
Soorten fossiele conservering  Beoordeling van de voordelen en risico's van de verwijdering van broeikasgassen op het land
Beoordeling van de voordelen en risico's van de verwijdering van broeikasgassen op het land
Hoofdlijnen
- Familiebanden Snapper leveren nieuw bewijs op over mariene reservaten
- (Her)verwerven van het potentieel om alles te worden
- Wetenschappers ontrafelen mysteries van DNA-replicatie in maïs
- Sardines nemen ons mee naar de bronnen van biodiversiteit in de Amazone-rivier
- Malawi wendt zich tot Britse troepen in stropersoorlog
- Eerste luxe Perigord-truffel wordt in Groot-Brittannië verbouwd
- Hoe te metaboliseren glucose om ATP te maken
Energie opgeslagen in de chemische bindingen van de koolhydraat-, vet- en eiwitmoleculen in levensmiddelen. Het proces van spijsvertering breekt koolhydraatmoleculen af in glucosemoleculen. Glucose die
- De verschillen tussen Mendelian & Polygenic Traits
- Waar wordt zetmeel opgeslagen in plantencellen?
- Onderzoekers ontdekken hoe botsende zuurstofmoleculen licht absorberen
- Wetenschappers ontwerpen veelbelovende nieuwe kathode voor op natrium gebaseerde batterijen

- Een goedkope biologische stoomgenerator om water te zuiveren

- Kathodemateriaal gemaakt van organische moleculen verbetert de groene eigenschappen van oplaadbare batterijen
- Nieuwe technologie maakt snelle eiwitsynthese mogelijk

 Hoe maak ik Saturnusringen voor wetenschapsprojecten
Hoe maak ik Saturnusringen voor wetenschapsprojecten Gedetailleerde fotodissociatiedynamiek van waterstofsulfide onthuld
Gedetailleerde fotodissociatiedynamiek van waterstofsulfide onthuld Wetenschappers onderzoeken hoe aerosoltypes wolkenvorming beïnvloeden
Wetenschappers onderzoeken hoe aerosoltypes wolkenvorming beïnvloeden Nieuwe aanpak verbetert de prestaties van thermo-elektrische materialen
Nieuwe aanpak verbetert de prestaties van thermo-elektrische materialen Soms, het loont de moeite om nederig te zijn:studeren
Soms, het loont de moeite om nederig te zijn:studeren Werknemers in de VS missen vaak ziekteverlof en gezondheidszorg - voordelen die in de meeste andere landen als vanzelfsprekend worden beschouwd
Werknemers in de VS missen vaak ziekteverlof en gezondheidszorg - voordelen die in de meeste andere landen als vanzelfsprekend worden beschouwd Interessante feiten over de geschiedenis van Parabolas
Interessante feiten over de geschiedenis van Parabolas  Opgevoerde inspanningen nodig om de binnenwateren van de wereld te beschermen
Opgevoerde inspanningen nodig om de binnenwateren van de wereld te beschermen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

