
Wetenschap
Nieuwe aanpak om peptidestapeling algemeen beschikbaar te maken
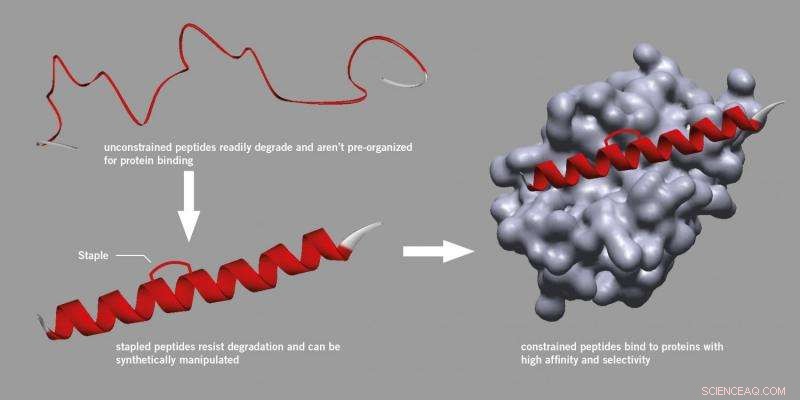
Peptide nieten. Krediet:Universiteit van Leeds
Britse wetenschappers hebben een nieuwe methode ontwikkeld om peptiden te structureren, waarvan ze zeggen dat het goedkoper zal zijn en het proces van het gebruik van geniete peptiden bij het ontdekken van geneesmiddelen veel breder beschikbaar zal maken.
De methode die is ontwikkeld door het negenkoppige team van de Universiteit van Leeds, en het benutten van synthetische chemie ontwikkeld aan het University College London, is veelzijdiger, goedkoper, volledig omkeerbaar en resulteert in peptiden waarvan de farmacokinetische eigenschappen, zoals oplosbaarheid kan gemakkelijk worden afgestemd, volgens professor Andrew Wilson, die de studie leidde.
De aanpak zou bekwame wetenschappers in staat kunnen stellen een peptide te beperken, afleveren aan een bepaalde cel en vervolgens de beperking opheffen, voorkomen dat het de cel weer verlaat.
Peptiden nuttiger maken
Wetenschappers en medicijnfabrikanten beschouwen peptiden over het algemeen met scepsis, geloven dat ze te onbetrouwbaar zijn om als medicijn te worden gebruikt, omdat ze gemakkelijk in cellen worden afgebroken en moeilijk te manipuleren zijn.
Onderzoek gestart aan de Harvard University vond echter een methode om een beugel te introduceren die aan een peptide kon worden bevestigd, de actieve structuur te versterken en stabieler te maken en minder snel te degraderen.
Dit proces, bekend als 'nieten' maakt gebruik van een specifieke synthetische methode en is nu een erkende benadering geworden bij het ontdekken van peptidegeneesmiddelen, zelfs resulterend in nieuwe startende bedrijven. Geniete peptiden breken niet af, binden beter aan eiwitten en hebben verbeterde farmacokinetische eigenschappen zoals celopname.
Eiwit-eiwit interacties
Er is een wijdverbreide verandering in het perspectief van peptiden ontstaan vanwege de noodzaak voor de farmaceutische industrie om geneesmiddelen te ontwikkelen die inwerken op eiwit-eiwit-interacties, in tegenstelling tot de traditionele 'lock-and-key'-modus van herkenning die door de meeste huidige medicijnen wordt gebruikt. Kleine moleculen die inwerken op eiwit-eiwit interacties moeten een groter, minder convex oppervlak bedekken.
Professor Wilson, wiens team aan dit probleem werkt, zei:"Wetenschappers hebben beperkt succes gehad bij het ontwikkelen van traditionele kleine moleculen die inwerken op eiwit-eiwitinteracties, en het op deze manier ontwikkelen van peptiden is een aantrekkelijk alternatief."
Hij voegde eraan toe:"De veel grotere niveaus van contact tussen het peptide en het eiwit kunnen worden benut om een hogere affiniteit en selectiviteit te bereiken. dus we zijn enthousiast geworden over deze alternatieve benadering van nieten."
Natuurlijk voorkomende aminozuren
Het team van de Universiteit van Leeds heeft het principe van peptidestapeling naar een nieuw niveau getild. De methode is gebaseerd op de reactie van twee thiolen in een peptidesequentie met een dibroommaleimidereagens.
Wanneer de twee thiolen correct in de peptidesequentie zijn geplaatst, resulteert de reactie erin dat de structuur wordt vergrendeld in een specifieke en bioactieve spiraalvorm die stabieler is.
De methode werkt op peptidesequenties die de natuurlijke en gangbare aminozuren cysteïne of homocysteïne bevatten. Dit zal toegang tot geschikte peptiden mogelijk maken via routinematige chemische en biologische methoden.
Professor Wilson, van de School of Chemistry van de University of Leeds en het Astbury Center for Structural Molecular Biology zei:"Onze benadering van eiwitstapeling is flexibeler, mogelijk goedkoper, en moet gemakkelijker te gebruiken zijn in de chemische biologie en de ontdekking van geneesmiddelen.
De volledige onderzoekspaper Double Quick, Double Click Reversible Peptide 'Stapling' is gepubliceerd in de Royal Society of Chemistry's Chemische Wetenschappen tijdschrift op 31 mei 2017.
Dr Michael Webb, Universitair hoofddocent organische chemie aan de Universiteit van Leeds, zei:"We hebben een nieuwe methode ontwikkeld om snel een functionele beperking in twee modelpeptiden te introduceren die een reeks biofysische en biochemische eigenschappen verbetert. In tegenstelling tot andere methoden kan het ook worden omgekeerd.
"Deze aanpak kan worden uitgevoerd met behulp van natuurlijk beschikbare aminozuren, mogelijk brengen van peptidenieten naar een grotere gemeenschap.
"Het vermogen om de beperking om te keren, kan de levering van op peptiden gebaseerde reagentia in de cel mogelijk maken, waar ze onbeperkt kunnen zijn en minder gemakkelijk weer naar buiten kunnen worden getransporteerd."
 Nieuwe uitbraak van koraalverbleking in Northern Territory een zorgwekkend teken van onze opwarmende oceanen
Nieuwe uitbraak van koraalverbleking in Northern Territory een zorgwekkend teken van onze opwarmende oceanen NASA ziet de ontwikkeling van de oostelijke Atlantische tropische storm Nadine
NASA ziet de ontwikkeling van de oostelijke Atlantische tropische storm Nadine NASA bevestigt zware regenval, versterking van tropische storm Marie
NASA bevestigt zware regenval, versterking van tropische storm Marie Bosbranden in Australië wakkeren oproepen tot inheemse brandpraktijken aan
Bosbranden in Australië wakkeren oproepen tot inheemse brandpraktijken aan Gletsjers en raadselachtige steenstrepen in de Ethiopische hooglanden
Gletsjers en raadselachtige steenstrepen in de Ethiopische hooglanden
Hoofdlijnen
- Wat veroorzaakt de dubbele helix om te draaien in een DNA-afbeelding?
- Deskundigen maken zich zorgen over rauw vlees-diëten voor katten en honden
- De meeste hondensnoepjes overschrijden de aanbevolen dagelijkse hoeveelheid energie
- Wat is het Baader-Meinhof-fenomeen?
- GMO-experimenten
- Unicorn Root herleeft zichzelf na 130 jaar
- Hoeveel Valence-elektronen heeft natrium?
- Nieuwe studie toont aan dat cannabis het geheugen van oudere muizen verhoogt
- Maleisië omarmt het werk van Melanies aan de illegale handel in wilde dieren
- Nieuw materiaal maakt koelapparaten energiezuiniger

- DESYs-röntgenbron PETRA III onthult details van adhesieve structuren van spinnenpoten

- Chitinase als verbrande brug Brownse monorail die op efficiënte wijze recalcitrante biomassa hydrolyseert
- CryoEM-onderzoek legt opioïde-signalering vast
- Hoog-entropie-gestabiliseerde chalcogeniden met hoge thermo-elektrische prestaties
 Een onderzoeksstudie analyseert de wervingspraktijken voor werkgelegenheid in Europa
Een onderzoeksstudie analyseert de wervingspraktijken voor werkgelegenheid in Europa Onderzoekers rapporteren Sweyntooth-kwetsbaarheden in 480 Bluetooth-apparaten
Onderzoekers rapporteren Sweyntooth-kwetsbaarheden in 480 Bluetooth-apparaten Wat zijn de functies van zetmeel in plantencellen?
Wat zijn de functies van zetmeel in plantencellen?  Kosten van COVID-19-zwendel zullen waarschijnlijk aanzienlijk stijgen, rapport concludeert
Kosten van COVID-19-zwendel zullen waarschijnlijk aanzienlijk stijgen, rapport concludeert Hoe kwantumtechnologie een revolutie teweeg kan brengen in de detectie en behandeling van ziekten
Hoe kwantumtechnologie een revolutie teweeg kan brengen in de detectie en behandeling van ziekten Perm-vulkanisme heeft bijgedragen aan het broeikasgasgehalte in de atmosfeer op Antarctica
Perm-vulkanisme heeft bijgedragen aan het broeikasgasgehalte in de atmosfeer op Antarctica Een nieuwe manier om de capaciteit van geheugenapparaten te vergroten
Een nieuwe manier om de capaciteit van geheugenapparaten te vergroten Twee nieuwe onderzoeken vergroten het begrip van stromingen die het klimaat helpen reguleren aanzienlijk
Twee nieuwe onderzoeken vergroten het begrip van stromingen die het klimaat helpen reguleren aanzienlijk
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

