
Wetenschap
Hoeveel gram ammoniumsulfaat is nodig om een 0,25 M oplossing te maken met een concentratie van 6M?
Massa =Molariteit x Volume x Molecuulgewicht
Gegeven:
Molariteit (M) =0,25 M
Volume (V) =1 L (ervan uitgaande dat we 1 liter van de oplossing willen maken)
Molecuulgewicht van ammoniumsulfaat ((NH4)2SO4) =132,14 g/mol
1. Bereken het benodigde aantal mol ammoniumsulfaat:
Mol =Molariteit x Volume
Mol =0,25 mol/L x 1 L =0,25 mol
2. Bereken de massa ammoniumsulfaat:
Massa =Mol x Molecuulgewicht
Massa =0,25 mol x 132,14 g/mol =33,04 g
Daarom is 33,04 gram ammoniumsulfaat nodig om een oplossing van 0,25 M te maken bij een concentratie van 6 M.
 Opgewonden multimeer gemedieerde supramoleculaire opconversie op lanthanide-organische assemblages met meerdere componenten
Opgewonden multimeer gemedieerde supramoleculaire opconversie op lanthanide-organische assemblages met meerdere componenten  Factoren die de pH van water in Wetlands
Factoren die de pH van water in Wetlands De structuur van de mysterieuze blauwe wervelende vlam onthullen
De structuur van de mysterieuze blauwe wervelende vlam onthullen Onderzoekers bedenken methode om het potentieel van veelgebruikte medicijnen te ontsluiten
Onderzoekers bedenken methode om het potentieel van veelgebruikte medicijnen te ontsluiten Hoe warmte reactie te vinden wanneer Zn reageert met HCl
Hoe warmte reactie te vinden wanneer Zn reageert met HCl
 Mudlarkers trekken historische artefacten uit Riverbank Muck
Mudlarkers trekken historische artefacten uit Riverbank Muck Bliksemstormen minder waarschijnlijk in een opwarmende planeet, studie suggereert:
Bliksemstormen minder waarschijnlijk in een opwarmende planeet, studie suggereert: Geschiedenis van het dumpen van DDT-oceaan voor de kust van LA nog erger dan verwacht, vindt EPA
Geschiedenis van het dumpen van DDT-oceaan voor de kust van LA nog erger dan verwacht, vindt EPA Koolstofvastlegging in oceanen aangedreven door fragmentatie van grote organische deeltjes
Koolstofvastlegging in oceanen aangedreven door fragmentatie van grote organische deeltjes Wat is een witte teek?
Wat is een witte teek?
Een teek is een klein spinachtig wezen dat bijt en hecht aan de huid van een dier of een mens. Eenmaal bevestigd, zal het vinkje zich voeden met het bloed van de gastheer totdat dat deel van zijn levenscyclus is geëindigd of
Hoofdlijnen
- Herstel van iconische inheemse vogel veroorzaakt problemen in stedelijke gebieden
- Welke naam wordt gegeven aan het organisme dat zich van afzonderlijke cellen tot vele soorten cellen ontwikkelt?
- In Ethiopië identificeren wetenschappers een fossiele otter ter grootte van een leeuw
- Onderzoekers ontwikkelen een basisdocument over de ontwikkeling van synthetische cellen
- Schildpad die vislijn heeft ingeslikt, losgelaten in oceaan
- Is er een psychologische reden waarom mensen gemeen zijn op internet?
- Hoe is taal geëvolueerd?
- Hoe komt de giraffe aan zijn lange nek? Aanwijzingen die nu worden onthuld door nieuwe genoomsequencing
- Verzadigde bodems kunnen van invloed zijn op de overleving van jonge bomen die zijn geplant om de klimaatverandering aan te pakken
- Tetraëders kunnen de uniciteit van wateren verklaren

- Hoe u vlakglas perfect om hoeken buigt

- Een zeer gevoelig en multi-analytisch systeem voor erfelijke nierziekte
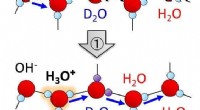
- Unieke structurele fluctuaties aan het ijsoppervlak bevorderen auto-ionisatie van watermoleculen
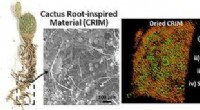
- Cactuswortels inspireren tot creatie van waterhoudend materiaal
 Kunnen we samenwerken met onze bacteriën om infecties te stoppen?
Kunnen we samenwerken met onze bacteriën om infecties te stoppen?  Heen en weer terug:Mantel xenon heeft een verhaal te vertellen
Heen en weer terug:Mantel xenon heeft een verhaal te vertellen De planeet redden te midden van een pandemie
De planeet redden te midden van een pandemie Hoe werkt Pop Rocks snoep?
Hoe werkt Pop Rocks snoep?  Waarom is een niet-metaalatoom elektronegatiever dan metaal?
Waarom is een niet-metaalatoom elektronegatiever dan metaal?  Enquête:bijna alle Amerikanen geven toe voedsel te verspillen
Enquête:bijna alle Amerikanen geven toe voedsel te verspillen NASA- en NOAA-satellieten laten zien dat Odile's overblijfsel door het zuiden van de VS raast
NASA- en NOAA-satellieten laten zien dat Odile's overblijfsel door het zuiden van de VS raast  De geschiedenis van de zon is geschreven op de maan
De geschiedenis van de zon is geschreven op de maan
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

