
Wetenschap
Een zeer gevoelig en multi-analytisch systeem voor erfelijke nierziekte
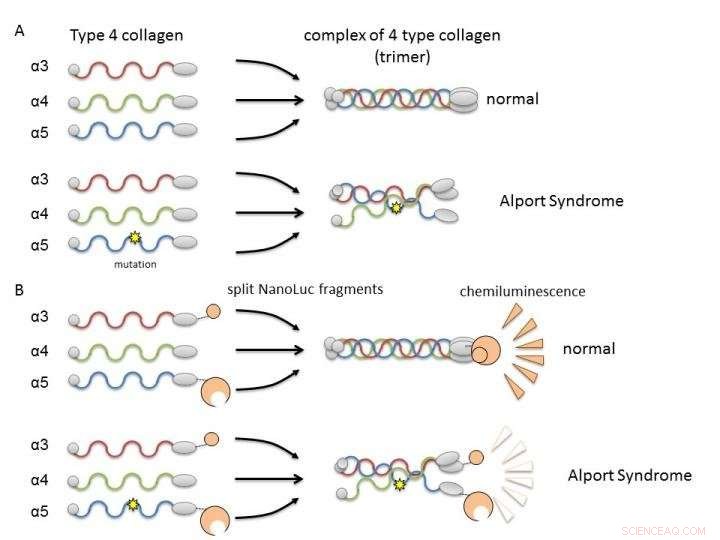
(A) Collageen IV alfa-3, alfa-4, en alfa-5 vormen normaal gesproken complexen (trimeren) en worden bestanddelen van het basaalmembraan in de nier. Bij het Alport-syndroom, genetische mutatie in een van de ketens verstoort de vorming van trimeren. (B) Door collageenketens te fuseren met Nanoluciferase-fragmenten, het is mogelijk om trimeervorming van alfa-3 te beoordelen, alfa-4, en alfa-5 door luminescentie-intensiteit. Krediet:Dr. Kohei Omachi
Syndroom van Alport (AS) is een erfelijke nierziekte die wordt veroorzaakt door een genetische mutatie die leidt tot afwijkingen van type IV collageen (Col4). Helaas, behandeling door de correctie van Col4-functionaliteit is nog niet ontwikkeld. Nutsvoorzieningen, onderzoekers van de Kumamoto University in Japan hebben een zeer gevoelige technologie ontwikkeld om de functionaliteit van Col4 te beoordelen, de weg vrijmaakt voor therapeutische medicijnen. Dit detectiesysteem vermindert de arbeids- en tijdkosten in vergelijking met conventionele methoden, en bewaakt de functionaliteit van Col4 met een hogere gevoeligheid dan ooit tevoren. Het systeem maakt het ook mogelijk om meerdere kandidaat-geneesmiddelen tegelijkertijd te analyseren.
Van ACE-remmers en andere medicijnen voor de behandeling van hypertensie is gevonden dat ze de progressie van AS vertragen. Echter, deze behandeling verlicht alleen de symptomen en kan de overgang naar nierfalen in het eindstadium niet voorkomen. Daarom wordt aangenomen dat de fundamentele behandeling gericht moet zijn op de oorzaak van het ontstaan van de ziekte, een aanpak die totaal verschilt van eerdere methoden. De therapeutische strategie, in dit geval, zou zich richten op het normaliseren van de functie van het veroorzakende eiwit met een kandidaat-geneesmiddelverbinding. Indien succesvol, deze techniek zou een grote bijdrage leveren aan de behandeling van andere erfelijke ziekten.
Om de functie van het veroorzakende eiwit te normaliseren met een kandidaat-geneesmiddelverbinding, het is noodzakelijk om verbindingen die de door de genetische mutatie aangetaste functie herstellen, efficiënt te screenen en te identificeren. Echter, een analysesysteem om de functionaliteit van oorzakelijke eiwitten te beoordelen is nog niet ontwikkeld. Een dergelijk systeem zou kunnen worden gebruikt om te screenen op therapeutische kandidaat-geneesmiddelen. Dus, Onderzoekers van de Kumamoto University wilden speciaal voor dat doel een nieuw evaluatiesysteem (een samengesteld screeningsysteem) opzetten.
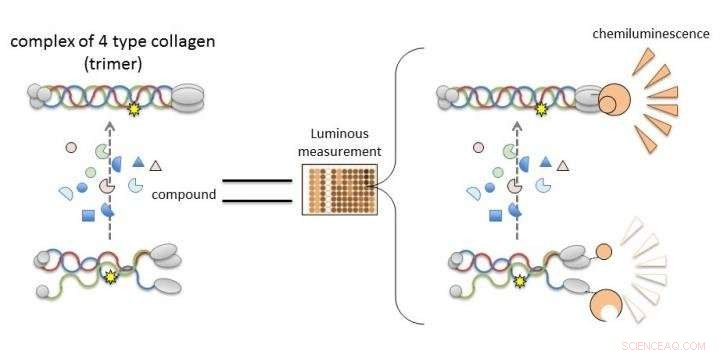
Collageen IV alfa-3, alfa-4, en alfa-5 bij het syndroom van Alport kunnen geen trimeren vormen, dus de ontdekking van verbindingen die leiden tot of hun vorming verbeteren, zal leiden tot de ontwikkeling van nieuwe therapieën. Nieuw werk van Kumamoto University maakt het mogelijk om de trimerisatie van collageen IV-alfaketens te evalueren door luminescentie te meten. Verbindingen die luminescentie induceren in het NanoLuc-Col4-systeem zullen waarschijnlijk trimerisatie bevorderen. Krediet:Dr. Kohei Omachi
In Col4, drie polypeptideketens (staafachtige eiwitten), alfa-3, alfa-4, en alfa-5, vormen een complex dat een eiwittrimeer wordt genoemd. Dit trimeer is een bestanddeel van het basaalmembraan in het deel van de nier dat de glomerulus wordt genoemd. Het glomerulaire basaalmembraan is een fysieke barrière tegen lekkage van bloedbestanddelen tijdens bloedfiltratie, een belangrijke nierfunctie voor de productie van urine. Een mutatie in een van de drie polypeptideketens kan de vorming van trimeer verstoren en resulteren in de ontwikkeling van AS als gevolg van het niet goed vormen van het basaalmembraan. Daarom, het is noodzakelijk om te zoeken naar verbindingen die de vorming van trimeer door mutant collageen kunnen corrigeren of ondersteunen.
De onderzoekers gebruikten split NanoLuciferase (split NanoLuc, NanoBiT) technologie voor eiwit-eiwit interactie-analyse als een methode om trimeervorming te evalueren. Fragmenten van twee grote en kleine luciferasemoleculen werden gefuseerd met alfa-3- en alfa-5-ketens en tot expressie gebracht in cellen met alfa-4-ketens. Meetbare luminescentie werd alleen gedetecteerd wanneer alfa-3, alfa-4, en alfa-5-ketens kunnen trimeren vormen.
De onderzoekers verduidelijkten dat het NanoLuc-Col4-systeem eerder gerapporteerde kenmerken van Col4 weerspiegelt, namelijk dat trimeren worden gevormd met een vaste combinatie van alfa-3, alfa-4, en alfa-5-ketens, en dat alfa-5-ketens geen trimeren kunnen vormen als ze een functioneel onderdeel missen. Het NanoLuc-Col4-systeem onthulde ook dat alfa-5-ketens met de genmutaties gerapporteerd in AS niet functioneerden. belangrijk, als bewijs van principe dat het corrigeren van trimeervorming voor mutant collageen haalbaar is, de auteurs konden het systeem gebruiken om verbindingen te identificeren die trimeervorming van alfa-3 konden induceren, alfa-4 en mutant alfa-5 collageen.
"Dit onderzoek moet een pad bieden om medicijnen voor erfelijke ziekten te ontwikkelen, zoals het Alport-syndroom, die momenteel ongeneeslijk zijn, " zei professor Hirofumi Kai van de afdeling Moleculaire Geneeskunde van de Kumamoto University.
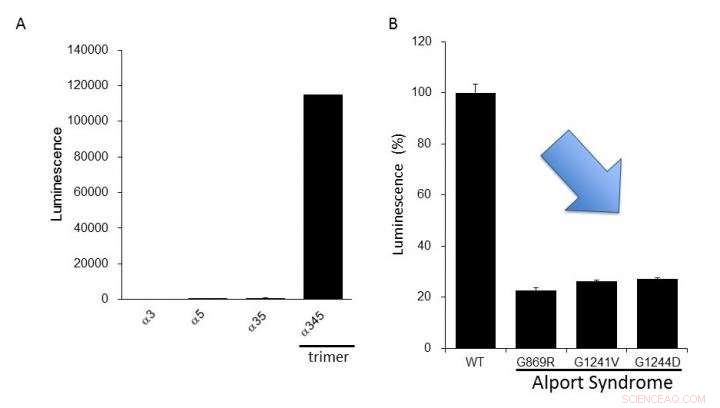
(A) Expressie van collageen IV alfa-3, alfa-4, en alfa-5 in cellen. Hoge luminescentie werd alleen geproduceerd bij de vorming van het alfa-345-trimeer. (B) Mutante alfa-5-eiwitten gerapporteerd in het Alport-syndroom hadden een trimeervorming die lager was dan die van het normale type (WT). Dit suggereert dat we functionele afwijkingen van collageen IV gevonden in het Alport-syndroom kunnen evalueren met behulp van dit testsysteem. Krediet:Dr. Kohei Omachi
 Sterkere westenwind waait slechte wind voor klimaatverandering
Sterkere westenwind waait slechte wind voor klimaatverandering Dodelijke Indonesische tsunami werd ontketend door aardverschuiving in Palu Bay, studie suggereert:
Dodelijke Indonesische tsunami werd ontketend door aardverschuiving in Palu Bay, studie suggereert: NASA vindt zee-ijs in de zomer van 2021 op de 12e plaats van laagste ooit geregistreerd
NASA vindt zee-ijs in de zomer van 2021 op de 12e plaats van laagste ooit geregistreerd Onderzoek naar overstromingsrisico's in Florida identificeert prioriteiten voor het kopen van onroerend goed
Onderzoek naar overstromingsrisico's in Florida identificeert prioriteiten voor het kopen van onroerend goed Enkele bomen van bovenaf diagnosticeren
Enkele bomen van bovenaf diagnosticeren
Hoofdlijnen
- Hoop voor honden met de meest voorkomende hart- en vaatziekten
- Hoe werken het ademhalings- en cardiovasculaire systeem samen?
- Gestrande walvisachtigen? Daar is een app voor
- Facilitated Diffusion: Definition, Example & Factors
- Neushoornstroper krijgt 20 jaar cel in Zuid-Afrika
- Onderzoek creëert een manier om varkens te beschermen tegen PRRS tijdens de voortplanting
- Wetenschap komt dichter bij het verklaren van de boze dronkaard
- De vliegsnelheid van vogels is complexer dan eerder werd gedacht
- Science Fair Project Ideas: Equine
- Nieuwe methode stimuleert de vorming van syngas uit biopolyolen
- "What is the Titration Curve?

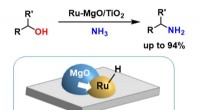
- Een verbeterde op ruthenium gebaseerde katalysator voor de synthese van primaire amines
- Onderzoeken naar enkelvoudige deeltjes wijzen de weg naar lichtschermen van de volgende generatie

- Nieuwe ontdekking van een zo sterke photobase, het verdient de bijnaam super

 Oorsprong van de Melkweg hypothetisch signaal van donkere materie is misschien niet zo donker
Oorsprong van de Melkweg hypothetisch signaal van donkere materie is misschien niet zo donker Barstende pulsar bleek te hikken tijdens cruciale fase van zijn levenscyclus
Barstende pulsar bleek te hikken tijdens cruciale fase van zijn levenscyclus Vier top-quarks tegelijk produceren om het onbekende te verkennen
Vier top-quarks tegelijk produceren om het onbekende te verkennen Lasertechnologie onthult middeleeuwse geheimen opgesloten in de kern van Alpine-ijs
Lasertechnologie onthult middeleeuwse geheimen opgesloten in de kern van Alpine-ijs Team zorgt voor stabiliteit van ontziltingsproces met magnesium
Team zorgt voor stabiliteit van ontziltingsproces met magnesium Videogamefanaten met een jeukende hit Twitch
Videogamefanaten met een jeukende hit Twitch Coronavirus-effecten die elementaire studenten en pas afgestudeerden schaden, deskundige zegt:
Coronavirus-effecten die elementaire studenten en pas afgestudeerden schaden, deskundige zegt: De zoektocht naar buitenaards leven in de waterwerelden dicht bij huis
De zoektocht naar buitenaards leven in de waterwerelden dicht bij huis
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

