
Wetenschap
Wat is de normaliteit van 28 ammoniumhydroxide?
Om de normaliteit van 28% ammoniumhydroxide (NH4OH) te berekenen, moeten we de concentratie NH4OH in mol per liter kennen.
De dichtheid van 28% ammoniumhydroxide is ongeveer 0,9 g/ml. Dit betekent dat 100 ml 28% NH4OH 90 g weegt.
De molaire massa van NH4OH is 35 g/mol.
Daarom is het aantal mol NH4OH in 90 g 28% NH4OH:
Mol NH4OH =(90 g)/(35 g/mol) =2,57 mol
Het volume van 90 g 28% NH4OH is:
Volume =(90 g)/(0,9 g/ml) =100 ml =0,1 l
Nu kunnen we de normaliteit van 28% ammoniumhydroxide berekenen:
Normaliteit =(mol NH4OH)/(volume in liters)
Normaliteit =(2,57 mol) / (0,1 L) =25,7 N
Daarom is de normaliteit van 28% ammoniumhydroxide ongeveer 25,7 N.
 VS begint formeel met terugtrekking uit klimaatakkoord Parijs
VS begint formeel met terugtrekking uit klimaatakkoord Parijs Verbetering van overstromingsprojecties, voorspellingen en bescherming in Venetië
Verbetering van overstromingsprojecties, voorspellingen en bescherming in Venetië Problemen met hoge waterstanden
Problemen met hoge waterstanden NASA ziet vorming van tropische cycloon Caleb bij Cocos Island
NASA ziet vorming van tropische cycloon Caleb bij Cocos Island Irma:omgevallen bomen en gezonken boten, maar zuchten van verlichting in Miami
Irma:omgevallen bomen en gezonken boten, maar zuchten van verlichting in Miami
Hoofdlijnen
- Onderzoekers ontdekken waarom de ziekteverwekker van buiktyfus zich alleen op mensen richt
- Zorgen voor het voortbestaan van olifanten in Laos:een kwestie van economie
- Wat de neus niet weet, helpt dieren in het wild:olfactorische signalen gebruiken om kwetsbare soorten te beschermen
- Toyocamycine-opnamewijze ontdekt:goed nieuws voor de ontwikkeling van antischimmelmiddelen
- Hoeveel cellen hebben levende wezens?
- Vechten of vluchten? Hoe vogels de mysteries van evolutie helpen onthullen
- Genetisch onderzoek toont aan dat vissen in de vroege zomer een evolutionaire impact kan hebben, wat resulteert in kleinere zalm
- Waarom husky’s blauwe ogen hebben
- Internationale samenwerking werkt om schimmelresistent katoen te kweken
- Gas omzetten in brandstoffen met betere legeringen
- De toekomst van elektronische apparaten:sterke en zelfherstellende iongels
- Een eerste in zijn soort katalysator bootst natuurlijke processen na om plastic af te breken en waardevolle nieuwe producten te produceren

- Onderzoekers begrijpen eindelijk de werkweek van enzymen

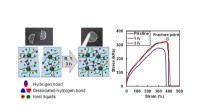
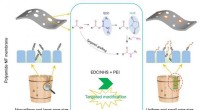
- Nieuwe gerichte modificatiestrategie verbetert de selectiviteit van polyamide nanofiltratiemembranen
 Demografische verschillen bevorderen sociale banden in online steungroepen, studie vondsten
Demografische verschillen bevorderen sociale banden in online steungroepen, studie vondsten Bijna 9 van de 10 niet-gehuisveste Detroit-studenten niet geïdentificeerd door scholen
Bijna 9 van de 10 niet-gehuisveste Detroit-studenten niet geïdentificeerd door scholen Een enorme vooruitgang in spectrometrie
Een enorme vooruitgang in spectrometrie Functies van asteroïden vernoemd naar mythische vogels
Functies van asteroïden vernoemd naar mythische vogels Nieuwe veiligheidstool kan managers helpen om werkplekken veiliger te maken
Nieuwe veiligheidstool kan managers helpen om werkplekken veiliger te maken Is calciumdinatriumedta organisch of anorganisch?
Is calciumdinatriumedta organisch of anorganisch?  Wetenschap zegt:die meteoor uit Michigan had vleziger kunnen zijn
Wetenschap zegt:die meteoor uit Michigan had vleziger kunnen zijn Chemici ontwikkelen motion capture-achtige technologie voor het volgen van eiwitvorm
Chemici ontwikkelen motion capture-achtige technologie voor het volgen van eiwitvorm
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

