
Wetenschap
Hoe verschilt waterstof van halogenen?
1. Reactiviteit: Waterstof is een zeer reactief element, terwijl halogenen ook zeer reactief zijn. De reactiviteit van waterstof komt echter voort uit zijn vermogen om één elektron te verliezen en een positief geladen ion (H+) te worden. Halogenen reageren daarentegen door één elektron te winnen en negatief geladen ionen te vormen (halogenide-ionen).
2. Elektronenconfiguratie: Waterstof heeft één valentie-elektron, waardoor het univalent is. Halogenen daarentegen hebben zeven valentie-elektronen, waardoor ze monovalent zijn. Dit verschil in elektronenconfiguratie resulteert in verschillend chemisch gedrag.
3. Oxidatietoestanden: Waterstof kan zowel positieve (+1) als negatieve (-1) oxidatietoestanden vertonen, waarbij respectievelijk hydride-ionen (H-) en protonen (H+) worden gevormd. Halogenen daarentegen vertonen meestal negatieve oxidatietoestanden en vormen halogenide-ionen (X-) wanneer ze één elektron verkrijgen.
4. Chemische binding: Waterstof kan deelnemen aan verschillende soorten chemische bindingen, waaronder covalente, ionische en metallische bindingen. Halogenen vormen voornamelijk covalente bindingen met andere elementen.
5. Fysieke eigenschappen: Waterstof is een kleurloos, geurloos diatomisch gas bij kamertemperatuur. Halogenen zijn bij kamertemperatuur diatomische gassen, maar hun kleuren variëren. Fluor (F2) is bijvoorbeeld lichtgeel, chloor (Cl2) is groengeel, broom (Br2) is roodbruin en jodium (I2) is zwart.
6. Smelt- en kookpunten: Waterstof heeft relatief lage smelt- en kookpunten vergeleken met halogenen. Dit komt omdat waterstofmoleculen alleen bij elkaar worden gehouden door zwakke Van der Waals-krachten. Halogenen hebben sterkere covalente bindingen, wat resulteert in hogere smelt- en kookpunten.
7. Voorkomen en overvloed: Waterstof is het meest voorkomende element in het universum, terwijl halogenen relatief zeldzaam zijn. Waterstof wordt voornamelijk aangetroffen in water en koolwaterstofbrandstoffen, terwijl halogenen als zouten aanwezig zijn in zeewater en verschillende mineralen.
8. Toxiciteit: Waterstof is niet giftig, maar halogenen kunnen op verschillende manieren giftig zijn. Fluor is bijvoorbeeld bijtend voor levende weefsels, chloor is een ontsmettingsmiddel, broom kan brandwonden en irritatie van de huid veroorzaken, en jodium is een antisepticum en kan giftig zijn als het in hoge doses wordt ingenomen.
Over het algemeen verschilt waterstof van halogenen in termen van reactiviteit, elektronenconfiguratie, oxidatietoestanden, chemische binding, fysische eigenschappen, voorkomen en overvloed, en toxiciteit. Deze verschillen worden toegeschreven aan de variaties in hun atomaire structuren en elektronenarrangementen.
Hoofdlijnen
- Bewijs dat mensen de wereld opnieuw hebben vormgegeven? Kippen
- De kaken van woestijnsprinkhanen scherpen zichzelf, ontdekt materiaalwetenschapper
- Wat is de functie van lymfeklieren?
- Bestaat er een wetenschappelijke formule voor grappig?
- Een plaag van onze eigen makelij:het onthullen van de ware oorsprong van de niet zo Duitse kakkerlak
- Te veel voertuigen, trage reacties en roekeloos samenvoegen:nieuw wiskundig model legt uit hoe verkeersbacteriën bewegen
- Wat zijn protosme's?
- Nieuwe studie heeft tot doel de redenen te begrijpen waarom genitale snijden bij vrouwen aanhoudt (update)
- Begrijpt jouw hond het als je zegt ‘haal de bal’? Een nieuwe studie in Hongarije zegt van wel
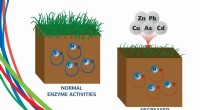
- Zware metalen maken bodemenzymen 3 keer zwakker
- Doe zoals de Romeinen:beton in elektriciteitscentrales wordt met de tijd sterker

- Een stap dichter bij milieuvriendelijke productie van waterstofbrandstof
- Koud gaan:de toekomst van elektronenmicroscopie

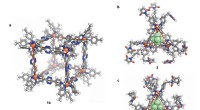
- Covalente modificatiecascade na assemblage van zelf-geassembleerde supramoleculaire structuren
 NASA-satellietgegevens laten zien dat Tapah extra-tropisch wordt
NASA-satellietgegevens laten zien dat Tapah extra-tropisch wordt Heb je je ooit afgevraagd waarom Britten zo slim klinken? Het onderscheidende gebruik van 'rechts' in Brits en Amerikaans Engels
Heb je je ooit afgevraagd waarom Britten zo slim klinken? Het onderscheidende gebruik van 'rechts' in Brits en Amerikaans Engels  Wat is de dichtheid van ijs en water bij 0 graden Celsius?
Wat is de dichtheid van ijs en water bij 0 graden Celsius?  Zullen tornado's en waterhozen gedijen als de aarde opwarmt?
Zullen tornado's en waterhozen gedijen als de aarde opwarmt?  Wat is de elektronenconfiguratie van germaniumion?
Wat is de elektronenconfiguratie van germaniumion?  Als bossen in rook opgaan, zal het klimaatplan van Californië dat ook doen
Als bossen in rook opgaan, zal het klimaatplan van Californië dat ook doen De omgeving verbeteren:wanneer oplossingen problemen worden
De omgeving verbeteren:wanneer oplossingen problemen worden Universeel geheugenonderzoek passeert nieuwe mijlpaal
Universeel geheugenonderzoek passeert nieuwe mijlpaal
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


