
Wetenschap
Dubbelgebrugde peptiden binden elk ziektedoelwit
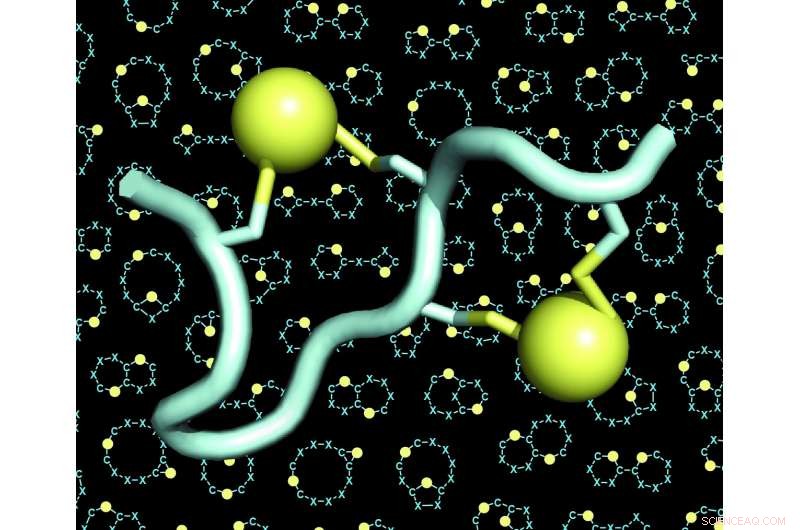
Een model van een dubbelgebrugd peptide (het peptide in lichtblauw, de twee bruggen in het geel). Op de achtergrond van de figuren zijn veel voorbeelden te zien van skeletten (ook wel 'scaffolds' of 'backbones' genoemd) van double-bridged peptiden. Krediet:C. Heinis/EPFL
Peptiden zijn korte ketens van aminozuren die aan eiwitten kunnen binden en hun functie kunnen veranderen. Ze vertonen een hoge bindingsaffiniteit, lage toxiciteit, en zijn gemakkelijk te synthetiseren, dit alles maakt peptiden ideaal voor gebruik bij de ontwikkeling van geneesmiddelen, en veel natuurlijk voorkomende peptiden zoals insuline, oxytocine, somatostatine en de antibiotica vancomycine of polymyxine B, worden veel gebruikt.
Echter, het gebruik van peptiden als medicijnen staat voor twee uitdagingen. Eerst, bindingsaffiniteit:Een goede binding vereist moeilijke peptide-architecturen en aminozuursequenties die perfect complementair zijn qua vorm en lading aan het oppervlak van hun doeleiwitten. Tweede, peptidestabiliteit:peptiden kunnen mogelijk door enzymen (proteasen) in kleinere, nutteloze fragmenten of zelfs losse aminozuren.
Het laboratorium van Christian Heinis bij EPFL heeft nu beide uitdagingen aangepakt door het nieuwe peptide-formaat te ontwikkelen dat ze 'dubbele overbrugde peptiden' noemen. Dit zijn ketens van 10 tot 15 aminozuren, waarvan er vier chemisch verbonden zijn door twee bruggen. Elke brug verbindt een paar van twee cysteïne-aminozuren - vier in totaal.
Omdat de vier cysteïnes in veel verschillende configuraties langs de volgorde van aminozuren kunnen worden geplaatst, dankzij de dubbele overbruggingsstrategie konden de onderzoekers een enorm groot aantal structureel diverse peptide-architecturen genereren. Ze breidden de diversiteit nog verder uit door verschillende chemische reagentia te gebruiken die het aantal bruggen verhoogden. De wetenschappers ontdekten ook dat de vier cysteïnes op drie verschillende manieren door twee linkers konden worden overbrugd, wat aanleiding geeft tot drie verschillende architecturen van elke afzonderlijke peptidesequentie.
Met behulp van deze strategie, de onderzoekers produceerden een enorme diversiteit aan peptidestructuren, allemaal met verschillende "skelet" -structuren. In aanvulling, de chemici veranderden systematisch de aminozuren tussen de cysteïnes en genereerden bibliotheken van miljarden verschillende dubbel-gebrugde peptiden. Na het screenen van de bibliotheken, de onderzoekers waren in staat om bindmiddelen met hoge affiniteit te isoleren voor belangrijke eiwitdoelen. Een van deze doelwitten was kallikreïne, een plasma-eiwit dat geassocieerd is met erfelijk angio-oedeem, een zeldzame zwellingsaandoening. Een andere was interleukine-17, een cytokine-eiwit dat betrokken is bij verschillende inflammatoire aandoeningen zoals reumatoïde artritis en psoriasis. Met behulp van de dubbele-brugbenadering voor beide eiwitdoelen, de wetenschappers ontwikkelden peptiden die ze efficiënt konden binden in nanomolaire concentraties. In het geval van kallikreïne, de peptiden konden het meer dan een uur binden voordat ze dissociëren.
Stabiliteit was ook een zeer aantrekkelijk kenmerk van het nieuwe peptideformaat. De dubbelgebrugde peptiden worden nauwelijks afgebroken door proteasen in het bloed, wat een groot voordeel is omdat het voorkomt dat de peptiden te snel worden geëlimineerd, waardoor hun therapeutische effecten worden uitgebreid. Op basis van de resultaten, Het laboratorium van Heinis past het peptideformaat nu toe op veel andere ziektedoelen. Ze hebben al nieuwe, zelfs grotere double-bridged peptidebibliotheken en screenden ze tegen een reeks ziekterelevante doelen. Een van deze peptiden ondergaat al een preklinische evaluatie.
 NIST zoektocht naar klimaatvriendelijke koelmiddelen levert ingewikkelde keuzes op
NIST zoektocht naar klimaatvriendelijke koelmiddelen levert ingewikkelde keuzes op Belang van biodiversiteit in bossen kan toenemen door klimaatverandering
Belang van biodiversiteit in bossen kan toenemen door klimaatverandering Bosbranden aan oostkust van Australië uit de hand gelopen
Bosbranden aan oostkust van Australië uit de hand gelopen NASA ziet krachtige onweersbuien in het centrum van Tropical Storm Lidias
NASA ziet krachtige onweersbuien in het centrum van Tropical Storm Lidias Meer evacuaties nu massale branden zich snel uitbreiden in Californië
Meer evacuaties nu massale branden zich snel uitbreiden in Californië
Hoofdlijnen
- De voor- en nadelen van het Bacillus-expressiesysteem
- Genetische veranderingen helpen muggen om aanvallen van pesticiden te overleven
- Vergroening van citrusvruchten behandelen met koper:effecten op bomen, bodems
- Genetische mutatie verklaart de oorsprong van sommige menselijke organen
- Hoe transhumanisme werkt
- Wat zijn de vier fasen van volledige glucose-afbraak?
- Relatie tussen DNA-basen Genen, eiwitten en eigenschappen
- De snelheid van verval berekenen
- Westerse steden proberen te voorkomen dat hongerige beren ravage aanrichten
- Wetenschappers ontwerpen manier om onschadelijke bacteriën te gebruiken om zware metalen in drinkwater te detecteren

- Experimentele tests van relativistische chemie zullen het periodiek systeem bijwerken

- Wetenschappers onthullen dubbele specificiteit van Vav2-SH2-eiwit
- Onderzoekers ontwikkelen nieuwe methode om snel, betrouwbaar monitoren van sikkelcelziekte
- Magnetische T-Budbots gemaakt van theeplanten doden en reinigen biofilms

 NASA's vroegste en grootste astronauten schitteren in nieuwe tentoonstelling
NASA's vroegste en grootste astronauten schitteren in nieuwe tentoonstelling Transactionele huwelijken waren ooit zo gewoon als huwelijken op basis van liefde
Transactionele huwelijken waren ooit zo gewoon als huwelijken op basis van liefde Facebook zegt hard op te treden tegen verkeerde informatie over klimaatverandering. Wetenschappers zeggen dat het niet genoeg doet.
Facebook zegt hard op te treden tegen verkeerde informatie over klimaatverandering. Wetenschappers zeggen dat het niet genoeg doet. Klimaatverandering, infectieziekte als grote bedreiging gezien:enquête
Klimaatverandering, infectieziekte als grote bedreiging gezien:enquête Biologisch afbreekbare nanodeeltjes glippen door slijm
Biologisch afbreekbare nanodeeltjes glippen door slijm Gezondheidsinformatie oogsten op een ongebruikelijke plek:de afvalwaterzuiveringsinstallatie
Gezondheidsinformatie oogsten op een ongebruikelijke plek:de afvalwaterzuiveringsinstallatie Onderzoekers ontdekken het vroegste superzware zwarte gat en de quasar in het heelal
Onderzoekers ontdekken het vroegste superzware zwarte gat en de quasar in het heelal Planten kunnen kiezen tussen alternatieve reacties op concurrentie
Planten kunnen kiezen tussen alternatieve reacties op concurrentie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

