
Wetenschap
Waarom brengen chemische reacties altijd een verandering in energie met zich mee?
De enthalpieverandering van een chemische reactie is de hoeveelheid warmte die wordt geabsorbeerd of vrijgegeven door de reactie bij constante druk. Als de enthalpieverandering van een reactie positief is, is de reactie endotherm en wordt warmte uit de omgeving geabsorbeerd. Als de enthalpieverandering van een reactie negatief is, is de reactie exotherm en komt er warmte vrij aan de omgeving.
De entropieverandering van een chemische reactie is de verandering in de mate van wanorde van het systeem tijdens de reactie. Als de entropieverandering van een reactie positief is, dan is de reactie spontaan en zal plaatsvinden zonder dat er een externe energiebron nodig is. Als de entropieverandering van een reactie negatief is, is de reactie niet-spontaan en zal deze niet plaatsvinden zonder de noodzaak van een externe energiebron.
De Gibbs-vrije energieverandering van een chemische reactie is de energie die beschikbaar is om tijdens de reactie arbeid te verrichten. Als de Gibbs-vrije energieverandering van een reactie negatief is, dan is de reactie spontaan en zal plaatsvinden zonder dat er een externe energiebron nodig is. Als de Gibbs-vrije energieverandering van een reactie positief is, dan is de reactie niet-spontaan en zal deze niet plaatsvinden zonder de noodzaak van een externe energiebron.
Samenvattend brengen chemische reacties altijd een verandering in energie met zich mee, omdat ze het verbreken en vormen van chemische bindingen met zich meebrengen. De hoeveelheid energie die wordt geabsorbeerd of vrijkomt tijdens een chemische reactie hangt af van de sterkte van de chemische bindingen die worden verbroken en gevormd. De enthalpieverandering, de entropieverandering en de Gibbs-vrije energieverandering van een chemische reactie zijn allemaal belangrijke factoren die bepalen of de reactie spontaan of niet-spontaan zal zijn.
 Recent verlies van gletsjers in de Russische noordpool verdubbelt ten opzichte van de afgelopen 60 jaar
Recent verlies van gletsjers in de Russische noordpool verdubbelt ten opzichte van de afgelopen 60 jaar Studie identificeert belangrijke belemmeringen voor de financiering van een duurzame oceaaneconomie
Studie identificeert belangrijke belemmeringen voor de financiering van een duurzame oceaaneconomie Het verwijderen van melkkoeien kan de toevoer van essentiële voedingsstoffen verminderen met weinig effect op de uitstoot van broeikasgassen
Het verwijderen van melkkoeien kan de toevoer van essentiële voedingsstoffen verminderen met weinig effect op de uitstoot van broeikasgassen Nieuw onderzoek zal de rundvleesindustrie helpen om de duurzaamheid te vergroten
Nieuw onderzoek zal de rundvleesindustrie helpen om de duurzaamheid te vergroten Hogere rekenvaardigheden leidden tot betere beslissingen over orkaanevacuatie door overheidsfunctionarissen
Hogere rekenvaardigheden leidden tot betere beslissingen over orkaanevacuatie door overheidsfunctionarissen
Hoofdlijnen
- Onderzoekers laten zien hoe opportunistische bacteriën concurrenten verslaan
- Waarom gebruikte Hooky de term cellen?
- Studie kan strategieën opleveren om het goede cholesterol te verhogen
- Onderzoekers bepalen hoe mechanische krachten de herkenning en signalering van T-cellen beïnvloeden
- Glycolyse aan kinderen leren
- Heeft de verzuring van de oceanen geleid tot het uitsterven van mariene weekdieren?
- Wat zijn de effecten van een alkalische pH op de structuur van DNA?
- Onderzoek toont aan hoe machinaal leren sociaal verzorgingsgedrag kan identificeren aan de hand van versnellingssignalen bij wilde bavianen
- Wat zijn de onderdelen van de celcyclus?
- Stickers en een smartphone voor eenvoudige nitrietdetectie op voedsel

- Een vetregulerend enzym kan de sleutel zijn tot obesitas, suikerziekte, kanker, andere ziekten
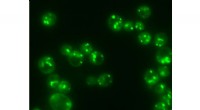
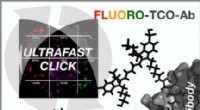
- Ultrasnelle herhaalde kleuring en ontkleuring van celmonsters voor tumordiagnostiek
- Recycling van polypropyleen uit tapijtafval

- Kristalstructuurvoorspelling van willekeurige legering met meerdere elementen
 Nieuwe dinosaurusontdekking in Zwitserland vult een gat in de evolutionaire geschiedenis van sauropoden
Nieuwe dinosaurusontdekking in Zwitserland vult een gat in de evolutionaire geschiedenis van sauropoden Dieren die in de hemellaag van het regenwoud leven
Dieren die in de hemellaag van het regenwoud leven  Jackiw-Rebbi zero-mode:het realiseren van niet-Abeliaans vlechtwerk in een niet-Majorana-systeem
Jackiw-Rebbi zero-mode:het realiseren van niet-Abeliaans vlechtwerk in een niet-Majorana-systeem Fysische principes gebruiken om te begrijpen hoe cellen zichzelf sorteren tijdens hun ontwikkeling
Fysische principes gebruiken om te begrijpen hoe cellen zichzelf sorteren tijdens hun ontwikkeling  Nieuwe röntgenmicroscopietechniek onthult geheimen op nanoschaal van oplaadbare batterijen
Nieuwe röntgenmicroscopietechniek onthult geheimen op nanoschaal van oplaadbare batterijen Mars trekt aan:hoe de interacties van de aarde met de rode planeet de diepzeecirculatie stimuleren
Mars trekt aan:hoe de interacties van de aarde met de rode planeet de diepzeecirculatie stimuleren  Geven dieren bewustzijn aan?
Geven dieren bewustzijn aan?  Onderzoekers ontdekken een familie van natuurlijke verbindingen die parasieten selectief doden
Onderzoekers ontdekken een familie van natuurlijke verbindingen die parasieten selectief doden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

