
Wetenschap
Zijn NACL ionische of covalente bindingen, waarom kan het geen binding zijn?
Dit komt omdat het elektronegativiteitsverschil tussen natrium en chloor aanzienlijk is. Elektronegativiteit meet de aantrekkingskracht van een atoom op elektronen. In het geval van NaCl heeft chloor een hogere elektronegativiteit dan natrium. Dit betekent dat chlooratomen sterker elektronen aantrekken dan natriumatomen, wat leidt tot de overdracht van elektronen van natrium naar chloor.
Als resultaat verliest natrium een elektron en wordt het een positief geladen ion (Na+), terwijl chloor een elektron krijgt en een negatief geladen ion (Cl-) wordt. De elektrostatische aantrekkingskracht tussen deze tegengesteld geladen ionen vormt de ionische binding in NaCl.
Bij covalente bindingen gaat het daarentegen om het delen van elektronen tussen atomen met vergelijkbare elektronegativiteiten. Daarom kan NaCl geen covalente bindingen vormen vanwege het aanzienlijke elektronegativiteitsverschil tussen natrium en chloor.
 Welke eigenschappen hebben alle polaire moleculen gemeen?
Welke eigenschappen hebben alle polaire moleculen gemeen?  Wat is een voorbeeld van een kernreactie?
Wat is een voorbeeld van een kernreactie?  Amerikaans aardgas exporteren? Niet zo snel, zegt Stanford-econoom
Amerikaans aardgas exporteren? Niet zo snel, zegt Stanford-econoom  Wat gebeurt er met het gas dat wordt opgevangen in de omgekeerde trechter van het sublimaat?
Wat gebeurt er met het gas dat wordt opgevangen in de omgekeerde trechter van het sublimaat?  Kunstmatig enzym kan een gen-switch activeren
Kunstmatig enzym kan een gen-switch activeren
 Hoe een kopje water de geheimen van ons universum kan ontsluiten
Hoe een kopje water de geheimen van ons universum kan ontsluiten  Critici van Green New Deal zien door de bomen het bos niet meer
Critici van Green New Deal zien door de bomen het bos niet meer Smaaktest? De voorkeuren van herten lijken de verspreiding van niet-inheemse invasieve planten te helpen
Smaaktest? De voorkeuren van herten lijken de verspreiding van niet-inheemse invasieve planten te helpen  Uit nieuw onderzoek blijkt dat de neerslagsnelheid in het Noordpoolgebied zal verdubbelen naarmate de temperatuur stijgt
Uit nieuw onderzoek blijkt dat de neerslagsnelheid in het Noordpoolgebied zal verdubbelen naarmate de temperatuur stijgt  Wat veroorzaakt meer extreme neerslag in het noordoosten?
Wat veroorzaakt meer extreme neerslag in het noordoosten?
Hoofdlijnen
- Maki's darmmicrobioom sterk beïnvloed door sociale kringen, studie zegt:
- Wat is een diatomische binding?
- Hoe cellen condensatie gebruiken om weefsels goed af te dichten
- Veel voorkomende medicijnen tegen brandend maagzuur kunnen kanker en andere immuunstoornissen bij honden helpen bestrijden, vinden onderzoekers
- Mutante wortels laten zien hoe we gewassen kunnen verbouwen in beschadigde bodems
- Ontwikkeling van een zeer nauwkeurig computermodel van het menselijk metabolisme
- Hoe wordt ureum gemaakt?
- Droogteresistente plantengenen kunnen de evolutie van waterbesparende gewassen versnellen
- Star Treks Kobayashi Maru Oefening verkent situaties zonder winstoogmerk
- Onderzoekers krijgen een glimp op nanoschaal van spleet- en putcorrosie terwijl het gebeurt

- Nobelprijs Scheikunde:Grote onderscheiding voor moleculaire zaken

- Levensduur van brandstofcellen gemaximaliseerd met kleine hoeveelheden metalen
- ORNL bereikt belangrijke FDA-mijlpaal voor kankerbestrijdende Ac-225-isotoop
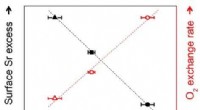
- Review benadrukt de kracht van eenvoudige fysieke modellen voor complexe eiwitmachines

 Studieprojecten een sleutelrol voor koolstofafvang en -opslag in China
Studieprojecten een sleutelrol voor koolstofafvang en -opslag in China Onderzoek werpt nieuw licht op krachten die gevoelige kustlijnen bedreigen
Onderzoek werpt nieuw licht op krachten die gevoelige kustlijnen bedreigen Het gemiddelde van twee percentages
Het gemiddelde van twee percentages Wanneer meer COVID-19-gegevens niet gelijk staan aan meer begrip
Wanneer meer COVID-19-gegevens niet gelijk staan aan meer begrip Een biocompatibele magnetische huid die nieuwe draagbare systemen mogelijk zou kunnen maken
Een biocompatibele magnetische huid die nieuwe draagbare systemen mogelijk zou kunnen maken Bacteriën gebruiken om CO2-afvang in oceanen te versnellen
Bacteriën gebruiken om CO2-afvang in oceanen te versnellen In welke toestand bestaat het chloorelement?
In welke toestand bestaat het chloorelement?  Glycanen als biomarkers voor kanker?
Glycanen als biomarkers voor kanker?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

