
Wetenschap
Welke eigenschappen hebben alle polaire moleculen gemeen?
1. Scheiding van lading :Polaire moleculen hebben een scheiding van lading, wat betekent dat ze een positief uiteinde en een negatief uiteinde hebben. Deze scheiding van lading creëert een dipoolmoment, dat een maat is voor de sterkte van de moleculaire polariteit.
2. Verschil in elektronegativiteit :De polariteit van een molecuul wordt bepaald door het verschil in elektronegativiteit tussen de atomen waaruit het molecuul bestaat. Elektronegativiteit is een maatstaf voor het vermogen van een atoom om elektronen aan te trekken. Wanneer het elektronegativiteitsverschil tussen twee atomen groot is, zal het molecuul meer polair zijn.
3. Bondpolariteit :De bindingen tussen atomen in een polair molecuul zijn polaire covalente bindingen. Polaire covalente bindingen treden op wanneer de elektronen in de binding ongelijk verdeeld zijn tussen de atomen. Deze ongelijke verdeling van elektronen creëert een gedeeltelijke positieve lading op het ene atoom en een gedeeltelijke negatieve lading op het andere atoom.
4. Moleculaire geometrie :De moleculaire geometrie van een polair molecuul heeft ook invloed op de polariteit ervan. Moleculen met een symmetrische moleculaire geometrie, zoals koolstofdioxide (CO2), hebben geen netto polariteit. Moleculen met een asymmetrische moleculaire geometrie, zoals water (H2O), hebben echter een netto polariteit.
5. Dipoolmoment :Het dipoolmoment van een polair molecuul is een maatstaf voor de sterkte van zijn polariteit. Het dipoolmoment is een vectorgrootheid die van het positieve uiteinde van het molecuul naar het negatieve uiteinde wijst. De grootte van het dipoolmoment is gelijk aan het product van de ladingsscheiding en de afstand tussen de positieve en negatieve uiteinden van het molecuul.
 Is koperacetaat een zwakke base?
Is koperacetaat een zwakke base?  Welke van de metalloïden heeft de kleinste atoomradius?
Welke van de metalloïden heeft de kleinste atoomradius?  Hoeveel valentie-elektronen moeten er in de Lewis-structuur worden ondergebracht voor F2?
Hoeveel valentie-elektronen moeten er in de Lewis-structuur worden ondergebracht voor F2?  Thermische eigenschappen van Black Iron Pipe
Thermische eigenschappen van Black Iron Pipe Onderzoekers ontwikkelen een reactor die chemicaliën voor altijd kan vernietigen
Onderzoekers ontwikkelen een reactor die chemicaliën voor altijd kan vernietigen
 Nieuw onderzoek helpt verklaren waarom mensen samenwerken als niemand kijkt
Nieuw onderzoek helpt verklaren waarom mensen samenwerken als niemand kijkt  Door de mens veroorzaakte aardbevingen dwingen Nederlanders de toekomst zonder gas tegemoet te treden
Door de mens veroorzaakte aardbevingen dwingen Nederlanders de toekomst zonder gas tegemoet te treden De ergste gevolgen van de klimaatverandering zijn wellicht de manier waarop de mensheid erop reageert
De ergste gevolgen van de klimaatverandering zijn wellicht de manier waarop de mensheid erop reageert  Suomi NPP vangt de geboorte van de tropische cycloon Ockhi . in het noorden van de Indische Oceaan
Suomi NPP vangt de geboorte van de tropische cycloon Ockhi . in het noorden van de Indische Oceaan Toekomstige oceaansteden hebben groene techniek boven en onder de waterlijn nodig
Toekomstige oceaansteden hebben groene techniek boven en onder de waterlijn nodig
Hoofdlijnen
- Hoe dichtheid de receptoractivatie op immuuncellen regelt
- De structuur die het cytoplasma in een bacteriecel omringt
- Waarom wordt colchicine gebruikt voor het bereiden van een metafasespread?
- Hoe snelheid de evolutionaire verandering van de wervelkolom bij zoogdieren beperkt
- Wat zijn reactanten en producten van de fructose-plus-glucose-is-sucrose-reactie?
- Grootte is belangrijk:hoe lichaamsgrootte de verouderingspatronen van honden bepaalt
- De functie van macromoleculen
- Waarom maakt het hebben van te veel opties het moeilijker om te kiezen?
- Een nieuw begrip van hoe cellen zichzelf verdedigen tegen bacteriële porievormende toxines
- Ultraheldere röntgenstralen laten zien hoe planten binnen een fractie van een seconde op licht reageren

- Onverwacht gedrag gezien bij efficiënte katalysatoren voor schone energie
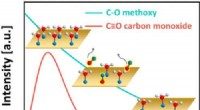
- Ammoniakafbraak voor waterstofeconomie, verbetering van de efficiëntie van waterstofextractie
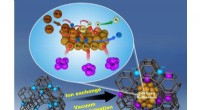
- Na een eeuw zoeken, wetenschappers vinden nieuwe vloeibare fase

- In Australië worden zelfsteriliserende micronaalden ontwikkeld voor veiligere vaccinaties
 Wat als uw energievoorziening door de wind opraakt?
Wat als uw energievoorziening door de wind opraakt?  Shoppers kopen eerder op Pi-dag en andere speciale promoties met een dagthema
Shoppers kopen eerder op Pi-dag en andere speciale promoties met een dagthema  Energieniveaus in het periodiek systeem
Energieniveaus in het periodiek systeem  Greening the greyfields:hoe onze buitenwijken te vernieuwen voor meer leefbare, net-zero steden
Greening the greyfields:hoe onze buitenwijken te vernieuwen voor meer leefbare, net-zero steden Keramische membranen scheiden kleine organische moleculen met een molecuulmassa van 200 Dalton
Keramische membranen scheiden kleine organische moleculen met een molecuulmassa van 200 Dalton De CO2-uitstoot in Londen daalt met 59% tijdens de COVID-19-lockdown
De CO2-uitstoot in Londen daalt met 59% tijdens de COVID-19-lockdown Een reus, zinderende planeet draait mogelijk om de ster Vega
Een reus, zinderende planeet draait mogelijk om de ster Vega Moleculair dunne interface tussen polymeren voor efficiënt koolstofdioxide-opvangmembraan
Moleculair dunne interface tussen polymeren voor efficiënt koolstofdioxide-opvangmembraan
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

