
Wetenschap
Hoe kom je erachter of een verbinding ionisch of covalent is?
Verschil in elektronegativiteit :
1. Ionische verbindingen :Ionische verbindingen worden gevormd als er een groot verschil in elektronegativiteit is tussen de betrokken atomen. Elektronegativiteit is het vermogen van een atoom om elektronen aan te trekken. Wanneer het elektronegativiteitsverschil tussen twee atomen groter is dan 1,7, hebben ze de neiging ionische bindingen te vormen.
2. Covalente verbindingen :Covalente verbindingen worden gevormd wanneer het elektronegativiteitsverschil tussen atomen relatief klein is (minder dan 1,7). Bij covalente bindingen worden elektronen gedeeld tussen atomen in plaats van volledig te worden overgedragen.
Aard van de binding :
1. Ionische verbindingen :Ionische verbindingen worden bij elkaar gehouden door elektrostatische krachten tussen positief geladen ionen (kationen) en negatief geladen ionen (anionen). Deze verbindingen vormen doorgaans kristallen met een regelmatige rangschikking van ionen.
2. Covalente verbindingen :Covalente verbindingen worden bij elkaar gehouden door covalente bindingen, waarbij elektronen tussen atomen worden gedeeld. Covalente bindingen kunnen enkelvoudig, dubbel of drievoudig zijn, afhankelijk van het aantal gedeelde elektronenparen.
Oplosbaarheid :
1. Ionische verbindingen :Ionische verbindingen zijn over het algemeen oplosbaar in polaire oplosmiddelen, zoals water. Watermoleculen kunnen de ionen in de verbinding scheiden vanwege hun polariteit.
2. Covalente verbindingen :Covalente verbindingen zijn vaak oplosbaar in niet-polaire oplosmiddelen, zoals organische oplosmiddelen. Niet-polaire oplosmiddelen hebben geen significant effect op de covalente bindingen.
Smelt- en kookpunten :
1. Ionische verbindingen :Ionische verbindingen hebben doorgaans hoge smelt- en kookpunten. Dit komt omdat er veel energie nodig is om de sterke elektrostatische krachten tussen de ionen te overwinnen.
2. Covalente verbindingen :Covalente verbindingen hebben over het algemeen lagere smelt- en kookpunten dan ionische verbindingen. Dit komt omdat covalente bindingen zwakker zijn dan ionische bindingen en er minder energie nodig is om ze te verbreken.
Door het elektronegativiteitsverschil, de aard van de binding, de oplosbaarheid en de smelt- en kookpunten van een verbinding te onderzoeken, kunt u bepalen of deze ionisch of covalent is.
Het is belangrijk op te merken dat er uitzonderingen kunnen zijn op deze algemene regels, en dat sommige verbindingen kenmerken van zowel ionische als covalente bindingen kunnen vertonen.
 Boreale bos- en toendragebieden zullen het zwaarst worden getroffen in de komende 500 jaar van klimaatverandering, zo blijkt uit het klimaatmodel
Boreale bos- en toendragebieden zullen het zwaarst worden getroffen in de komende 500 jaar van klimaatverandering, zo blijkt uit het klimaatmodel  COVID-19:economische vertraging houdt de klimaatverandering niet tegen
COVID-19:economische vertraging houdt de klimaatverandering niet tegen Draaimolen voor weer vormt nieuwe risico's voor het door brand geteisterde Australië
Draaimolen voor weer vormt nieuwe risico's voor het door brand geteisterde Australië De exodus van het Vanuatu-eiland gaat door, zelfs als de vulkaan zich stabiliseert
De exodus van het Vanuatu-eiland gaat door, zelfs als de vulkaan zich stabiliseert Wat we weten over hoe chemicaliën voor altijd de gezondheid beïnvloeden
Wat we weten over hoe chemicaliën voor altijd de gezondheid beïnvloeden
Hoofdlijnen
- Tropische vogel waarschijnlijk uit koers geblazen door orkaan Jose
- Hoe bepaal je een eigenfrequentie?
- Georganiseerd worden:onderzoek laat zien hoe borstcelgemeenschappen zich in weefsel organiseren
- Vrienden tot het einde? Sociale signalen zorgen ervoor dat vissen de overlevingstactiek vertragen
- Het idee testen dat milieu-uitdagingen de evolutie van grotere hersenen stimuleren
- Uit onderzoek blijkt dat plastic vezels de groei van mosselen met meer dan een derde belemmeren. Dit is waarom dit zorgwekkend is
- Hoe bloedstamcellen hun levenslange potentieel voor zelfvernieuwing behouden
- Hoe het coronavirus interageert met cellen
- Hoe gist reageert op verandering:Ontwikkeling van een nieuw protocol maakt het mogelijk om complete set eiwitniveaus te meten
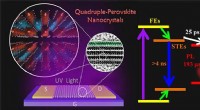
- Wetenschappers onthullen dynamisch mechanisme van loodvrije viervoudige perovskiet-nanokristallen
- Het maken van mRNA met een volledig chemisch proces kan aangepaste mRNA-vaccins mogelijk maken

- Een nieuwe vloeibare kristalinkt voor 3D-printen
- Doorbraak in origami-diagnostiek komt ten goede aan boeren in ontwikkelingslanden

- David vs Goliath:hoe een klein molecuul astma-aanvallen kan verslaan
 Branden in Californië:nieuwe branden terwijl gevaarlijke wind de vlammen aanwakkert
Branden in Californië:nieuwe branden terwijl gevaarlijke wind de vlammen aanwakkert Wetenschappers stellen een alles-in-één oppervlakteontwerp voor van koperen nanodraden voor om een ontdooi-efficiëntie van ~100% te bereiken
Wetenschappers stellen een alles-in-één oppervlakteontwerp voor van koperen nanodraden voor om een ontdooi-efficiëntie van ~100% te bereiken  Hoe zich te ontdoen van een vierkantswortel in een vergelijking
Hoe zich te ontdoen van een vierkantswortel in een vergelijking  Wiskunde stelt wetenschappers in staat de organisatie binnen een celkern te begrijpen
Wiskunde stelt wetenschappers in staat de organisatie binnen een celkern te begrijpen Onderzoekers stellen het beste loot box-model voor om de gamewinst te maximaliseren
Onderzoekers stellen het beste loot box-model voor om de gamewinst te maximaliseren Bali stopt sociale media voor Dag van Stilte
Bali stopt sociale media voor Dag van Stilte Wegenplanning kan de voedselproductie stimuleren en tegelijkertijd de tropische bossen helpen beschermen
Wegenplanning kan de voedselproductie stimuleren en tegelijkertijd de tropische bossen helpen beschermen Studie weerlegt het verhaal dat daklozen op straat servicebestendig zijn
Studie weerlegt het verhaal dat daklozen op straat servicebestendig zijn
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

