
Wetenschap
Hoe kun je het effect van druk op de oplosbaarheid van kooldioxidegas in water aantonen?
Materialen:
- Twee helderglazen flessen met doppen
- Koud kraanwater
- Kooldioxidegasfles of een koolzuurhoudende drank (bijvoorbeeld frisdrank of bruisend water)
- Manometer (optioneel)
Procedure:
1. Vul beide glazen flessen met een gelijke hoeveelheid koud kraanwater.
2. Sluit een van de flessen goed af met de dop. Dit zal dienen als controlefles.
3. Sluit de kooldioxidegascilinder aan of gebruik een koolzuurhoudende drank om kooldioxidegas in de andere fles te brengen. Voeg gas toe totdat de fles onder druk staat. Controleer, indien beschikbaar, de druk in de fles met behulp van de manometer.
4. Sluit de fles met kooldioxidegas goed af met de dop.
5. Zet beide flessen een paar minuten op kamertemperatuur zodat het gas in het water kan oplossen.
Opmerkingen:
Open beide flessen en let op het volgende:
1. In de controlefles mag er weinig tot geen kooldioxidegas aanwezig zijn, omdat dit in evenwicht is met de atmosfeer.
2. In de fles die onder druk stond met kooldioxidegas, moet u de aanwezigheid van luchtbellen of bruisen waarnemen, wat wijst op het opgeloste kooldioxidegas.
Uitleg:
De wet van Henry stelt dat de oplosbaarheid van een gas in een vloeistof recht evenredig is met de partiële druk van dat gas boven de vloeistof. Met andere woorden:naarmate de druk van kooldioxidegas toeneemt, neemt ook de oplosbaarheid ervan in water toe.
Wanneer u de fles onder druk zet met kooldioxidegas, verhoogt u de partiële druk van kooldioxide boven het water. Hierdoor worden meer kooldioxidemoleculen in het water gedreven, wat leidt tot een toename van de oplosbaarheid van kooldioxide in het water.
Door de controlefles (zonder toegevoegde druk) te vergelijken met de fles onder druk, kunt u duidelijk het effect van druk op de oplosbaarheid van kooldioxidegas in water waarnemen.
 Geowetenschappers ontdekken dat ondiepe afvalwaterinjectie diepe aardbevingen in Texas veroorzaakt
Geowetenschappers ontdekken dat ondiepe afvalwaterinjectie diepe aardbevingen in Texas veroorzaakt Nieuwe studie ontrafelt geheim van subductie
Nieuwe studie ontrafelt geheim van subductie Plasticvervuiling zorgt ervoor dat mosselen grip verliezen
Plasticvervuiling zorgt ervoor dat mosselen grip verliezen Door vliegers geblazen Antarctische ontdekkingsreizigers maken de meest zuidelijke positie van Galileo vast
Door vliegers geblazen Antarctische ontdekkingsreizigers maken de meest zuidelijke positie van Galileo vast Mexico Baja California zet zich schrap voor orkaan Kay
Mexico Baja California zet zich schrap voor orkaan Kay
Hoofdlijnen
- Onderzoekers vinden aanwijzingen om te verduidelijken waarom cohesine een rol speelt bij kanker en de ontwikkeling van het hart
- Celmodellen voor wetenschapsprojecten
- Wiskunde legt uit hoe gigantische draaikolken ontstaan bij de ontwikkeling van eicellen
- Onderzoek laat zien hoe mariene bacteriën algen bestrijden
- Mensen zijn geëvolueerd met hun microbioom. Net als genen gaan je darmmicroben van de ene generatie naar de volgende
- De hectische 24-uurs inspanning om een bedreigde, verweesde vleermuis
- Aanpassing van het fotosynthesemechanisme in luchtplanten vindt plaats door middel van genduplicatie, zo blijkt uit onderzoek
- In planten is eenvoudige suiker het minst waarschijnlijk?
- Onderzoek naar factoren die ten grondslag kunnen liggen aan de manier waarop huiskatten in groepen kunnen leven
- In vivo geneesmiddelontdekking voor het verhogen van incretine tot expressie brengende cellen bij diabetes

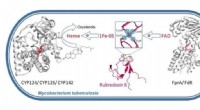
- Nieuwe studie verklaart Mycobacterium tuberculosis hoge weerstand tegen medicijnen en immuniteit
- Pavlovs klassieke conditionering inspireert materiaalwetenschappers

- Nieuwe katalysator verbetert broeikasgas tot hernieuwbare koolwaterstoffen

- Techniek verdubbelt conversie van CO2 naar plastic component

 Lagere goedkeuringspercentages bewijs van discriminatie voor leners van hetzelfde geslacht
Lagere goedkeuringspercentages bewijs van discriminatie voor leners van hetzelfde geslacht Underdog-telefoonmakers proberen te ontsnappen aan de schaduw van reuzen op de topbeurs
Underdog-telefoonmakers proberen te ontsnappen aan de schaduw van reuzen op de topbeurs Hoe de Noordelijke IJszee zout werd
Hoe de Noordelijke IJszee zout werd Van colablikjes tot schoenenmenu's:wat zit er achter de opkomst van gepersonaliseerde producten?
Van colablikjes tot schoenenmenu's:wat zit er achter de opkomst van gepersonaliseerde producten?  Onderzoek toont vooroordelen aan tegen Amerikaanse immigranten met niet-verengelste namen
Onderzoek toont vooroordelen aan tegen Amerikaanse immigranten met niet-verengelste namen Wat als muggen uitgestorven zijn?
Wat als muggen uitgestorven zijn?  Barry verzwakt, maar Amerikaanse functionarissen waarschuwen voor zware regenval, overstromingen, tornado's
Barry verzwakt, maar Amerikaanse functionarissen waarschuwen voor zware regenval, overstromingen, tornado's Moleculair magnetisme combineert kracht met boodschapperelektron
Moleculair magnetisme combineert kracht met boodschapperelektron
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

