
Wetenschap
Wat zijn de definities van beperkende reactanten in de chemie?
1. Volledig verbruik: De beperkende reactant is de reactant die tijdens de reactie volledig wordt opgebruikt, waardoor de maximale hoeveelheid product die kan worden verkregen wordt gecontroleerd. Zodra de beperkende reactant is uitgeput, stopt de reactie, zelfs als er een overmaat aan andere reactanten aanwezig is.
2. Gebalanceerde chemische vergelijking: De stoichiometrische coëfficiënten in een uitgebalanceerde chemische vergelijking geven de molverhoudingen aan waarin reactanten samenkomen om producten te vormen. Op basis van deze molverhoudingen kunnen we de kwantitatieve relatie tussen bepalen
reactanten die nodig zijn om de reactie te laten verlopen zonder dat er een overmaat achterblijft.
Voorbeeld :Beschouw de uitgebalanceerde chemische vergelijking voor de verbranding van methaan
```
CH4 + 2O2 -> CO2 + 2H2O
```
Als we beginnen met 2 mol CH4 en 8 mol O2, is het essentieel om uit te zoeken welke reactant volledig zal worden verbruikt en als beperkend reagens zal dienen:
- Voor CH4:
Molverhouding =mol CH4 / stoichiometrische coëfficiënt van CH4
=2 mol / 1 =2:1
Deze verhouding houdt in dat we voor elke mol CH4 2 mol O2 nodig hebben om te reageren.
- Voor O2:
Molverhouding =mol O2 / stoichiometrische coëfficiënt van O2
=8 mol / 2 =4:1
Deze verhouding suggereert dat we voor elke mol CH4 2 mol O2 nodig hebben om te reageren. Als we de molverhoudingen vergelijken, zien we dat CH4 een lagere molverhouding (2:1) heeft vergeleken met O2 (4:1). Met andere woorden, voor elke mol CH4 hebben we slechts 2 mol O2 nodig, maar we hebben een overmaat aan O2 (8 mol), die niet gereageerd zal blijven nadat de CH4 is uitgeput. CH4 zal eerst volledig reageren, waardoor het de beperkende reactant wordt. De maximale hoeveelheid product (CO2 en H2O) die kan worden gevormd, wordt daarom bepaald door de hoeveelheid CH4 die in het systeem beschikbaar is. Het identificeren van de beperkende reactant is van cruciaal belang voor nauwkeurige stoichiometrische berekeningen en voor het optimaliseren van de efficiëntie van chemische reacties.
 Hoe de klimaatverandering de transitie van nomadische jager-verzamelaars naar nederzettingen en landbouwsamenlevingen stimuleerde
Hoe de klimaatverandering de transitie van nomadische jager-verzamelaars naar nederzettingen en landbouwsamenlevingen stimuleerde  Het milieu verdedigen is nu dodelijker dan soldaten in sommige oorlogsgebieden
Het milieu verdedigen is nu dodelijker dan soldaten in sommige oorlogsgebieden Nieuwe scheuren spuwen lava terwijl de vulkaan Hawaï voor de tweede week uitbarst
Nieuwe scheuren spuwen lava terwijl de vulkaan Hawaï voor de tweede week uitbarst Het offshore boorplan van Trump ligt mogelijk dood in het water maar er zijn betere manieren om te leiden op energie
Het offshore boorplan van Trump ligt mogelijk dood in het water maar er zijn betere manieren om te leiden op energie De dieptepunten en dieptepunten van het Antarctische zee-ijs
De dieptepunten en dieptepunten van het Antarctische zee-ijs
Hoofdlijnen
- Een probioticum voor onze longen? Nieuw onderzoek roept vragen op over de toekomst van de behandeling van COVID-19
- Hoe cellen hun grenzen beheren
- Is de computer een goed model voor de hersenen?
- Wetenschappers vinden ontbrekende aanwijzing over hoe hiv cellen hackt om zichzelf te verspreiden
- Wat zijn de verschillen tussen de evolutietheorie en tegenstrijdige theorieën?
- Wat gebeurt er met een dierlijke cel in zuiver water? Waarom gebeurt dit niet bij een plantencel?
- Meelkracht om voedselzekerheid te vergroten
- Nieuwe informatie over hoe afvaletende bacteriën complexe koolstofatomen verteren, zou kunnen leiden tot het recyclen van plastic en plantaardig afval
- Behoefte aan snelheid maakt genoombewerking efficiënt, zo niet beter
- Gerecycled katoen wordt nieuwe stof

- Effecten van een belangrijk medicijndoelwit gereguleerd door moleculaire codes
- Ozon breekt THC af dat is afgezet op oppervlakken van derdehands cannabisrook

- Nieuw voedsel invriesconcept verbetert kwaliteit, verhoogt de veiligheid, vermindert energieverbruik

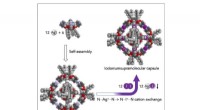
- Een nieuwe hexamere moleculaire capsule van nanoformaat
 Nieuwe inzichten in magnetische kwantumeffecten in vaste stoffen
Nieuwe inzichten in magnetische kwantumeffecten in vaste stoffen Begrijpen waarom zangvogels hun huis kiezen
Begrijpen waarom zangvogels hun huis kiezen  Waarom lijken orkanen te bewegen alsof ze er niet aan toe zijn
Waarom lijken orkanen te bewegen alsof ze er niet aan toe zijn  Rapport identificeert grote uitdagingen om beter voor te bereiden op vulkaanuitbarstingen
Rapport identificeert grote uitdagingen om beter voor te bereiden op vulkaanuitbarstingen Religie is uniek menselijk, maar computersimulaties kunnen ons helpen religieus gedrag te begrijpen
Religie is uniek menselijk, maar computersimulaties kunnen ons helpen religieus gedrag te begrijpen Is het een jongen? Tropische depressie 18-E ontstaat in de oostelijke noordelijke Stille Oceaan
Is het een jongen? Tropische depressie 18-E ontstaat in de oostelijke noordelijke Stille Oceaan  Zijn flexibele, klapperende vliegmachines in onze toekomst?
Zijn flexibele, klapperende vliegmachines in onze toekomst?  Duurzame brandstofmengsels kunnen luchtvaartmaatschappijen helpen om hun werk op te schonen
Duurzame brandstofmengsels kunnen luchtvaartmaatschappijen helpen om hun werk op te schonen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

