
Wetenschap
Welke factoren bepalen de spanning in een voltaïsche cel?
1. Elektrodepotentiaal:
- Standaard elektrodepotentiaal (E°): Dit is het potentiaalverschil tussen de standaard waterstofelektrode (SHE) en de andere halfcelelektroden onder standaardomstandigheden (temperatuur van 25°C, concentratie van 1M en druk van 1 atm). De standaardelektrodepotentiaal is een maatstaf voor de neiging van een elektrode om oxidatie of reductie te ondergaan.
- Nernst-vergelijking: De Nernst-vergelijking houdt rekening met niet-standaard omstandigheden zoals veranderingen in concentratie en temperatuur, waardoor de standaard elektrodepotentiaal wordt gewijzigd. De Nernst-vergelijking wordt gegeven door:
```
E =E° - (0,0592/n) log Q
```
waarbij E de elektrodepotentiaal is onder niet-standaard omstandigheden, E° de standaard elektrodepotentiaal is, Q het reactiequotiënt is, n het aantal mol elektronen is dat wordt overgedragen in de gebalanceerde halfreactie, en 0,0592 V de constante is die verband houdt met temperatuur en de constante van Faraday.
2. Concentratie van reactanten en producten:
- De concentratie van reactanten en producten die betrokken zijn bij de halfreacties beïnvloedt de spanning van een voltaïsche cel. Volgens de Nernst-vergelijking zullen hogere concentraties reactanten en lagere concentraties producten de spanning van de cel verhogen.
3. Temperatuur:
- Temperatuur beïnvloedt de snelheid van chemische reacties en de activiteit van de reactanten en producten. Een temperatuurstijging verhoogt doorgaans de celspanning omdat de entropieverandering (ΔS) gunstiger wordt bij hogere temperaturen.
4. Oppervlakte van elektroden:
- Het oppervlak van de elektroden speelt een rol bij de snelheid van elektrochemische reacties. Een groter oppervlak zorgt ervoor dat er meer reacties tegelijkertijd kunnen plaatsvinden, wat resulteert in een hogere celspanning.
5. Ionische sterkte en ionsoorten in oplossing:
- De aanwezigheid van andere ionen in de elektrolytoplossing kan de activiteitscoëfficiënten van de reactanten en producten beïnvloeden, waardoor de spanning wordt beïnvloed. Het toevoegen van inerte elektrolyten (zoals KNO3) kan een hoge ionsterkte behouden en veranderingen in activiteitscoëfficiënten minimaliseren, wat leidt tot stabielere celspanningsmetingen.
6. Referentie-elektrode:
- De referentie-elektrode (meestal de standaard waterstofelektrode of SHE) biedt een stabiele potentiaal waartegen de potentiaal van de andere elektrode (de werkelektrode) wordt gemeten. De referentie-elektrode helpt bij het handhaven van een constant potentieel en maakt nauwkeurige metingen mogelijk.
7. Celontwerp:
- Factoren zoals de afstand tussen de elektroden, het gebruikte type elektrolyt (waterig of niet-waterig), elektrodematerialen en celontwerp kunnen ook van invloed zijn op de spanning van de voltaïsche cel.
Samenvattend wordt de spanning van een voltaïsche cel bepaald door de standaard elektrodepotentialen van de halfcellen, de concentraties van de reactanten en producten, de temperatuur, het oppervlak van de elektroden, de aanwezigheid van andere ionen in oplossing, de keuze van de referentie-elektrode en het algehele celontwerp.
 Hebben alle gassen met hetzelfde volume en dezelfde druk een aantal atomen?
Hebben alle gassen met hetzelfde volume en dezelfde druk een aantal atomen?  Wat zijn de overeenkomsten die metalen en niet-metalen gemeen hebben?
Wat zijn de overeenkomsten die metalen en niet-metalen gemeen hebben?  Welk molecuul wordt in het Lewis-model als een base beschouwd, maar niet in het Bronsted-Lowry- of Arrhenius-model?
Welk molecuul wordt in het Lewis-model als een base beschouwd, maar niet in het Bronsted-Lowry- of Arrhenius-model?  Wat is de houdbaarheid van kopernitraat?
Wat is de houdbaarheid van kopernitraat?  Wanneer kleine goudvlokken uit een wateroplossing worden verwijderd door het filteren van de Is dit een fysieke verandering?
Wanneer kleine goudvlokken uit een wateroplossing worden verwijderd door het filteren van de Is dit een fysieke verandering?
 Prachtige verloren vintage uit Bordeaux drijft kleine telers tot het uiterste
Prachtige verloren vintage uit Bordeaux drijft kleine telers tot het uiterste Tasmanië herbergt bedreigde oude culturele landschappen
Tasmanië herbergt bedreigde oude culturele landschappen Klimaatverandering maakt zomerweer stormachtiger en toch meer stagnerend
Klimaatverandering maakt zomerweer stormachtiger en toch meer stagnerend Politieke opvattingen hebben een beperkte invloed op hoe we klimaatafwijkingen waarnemen, studie vondsten
Politieke opvattingen hebben een beperkte invloed op hoe we klimaatafwijkingen waarnemen, studie vondsten Inheemse kennis sleutel tot succesvol ecosysteemherstel
Inheemse kennis sleutel tot succesvol ecosysteemherstel
Hoofdlijnen
- Oude genen houden zeeanemonen voor altijd jong
- Dr. YouTube... wat is uw diagnose?
- Hoe dierproeven werken
- Onderzoek laat zien hoe honingbijen dode partners herkennen
- Waar haalt het hoornvlies zuurstof vandaan?
- Welke celstructuur fungeert als opslagplaats voor de cel?
- Top 5 onopgeloste hersenmysteries
- Welke soort weefsel geeft de meeste tijd in interfase?
- Hoe zorgden dinosaurussen voor botverpletterende beten? Door een stijve onderkaak te houden.
- Onderzoekers rapporteren efficiënte platformtechnologie voor de productie van cefalosporine-antibiotica

- X-ray laser sight onthult medicijndoelen

- Werkingsmechanisme van cholecystokininereceptoren onthuld
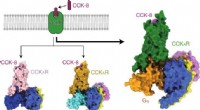
- Natuurlijke antibiofilm en antimicrobiële peptiden van micro-organismen

- Ontwikkeling van anorganisch loodvrij perovskiet voor breedbandemissie
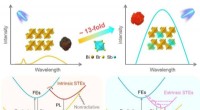
 Lasers om de oorsprong van het leven op een ijskoude maan te onderzoeken en de ruimte-tijdpuls van sterrenverpletterende botsingen op te nemen
Lasers om de oorsprong van het leven op een ijskoude maan te onderzoeken en de ruimte-tijdpuls van sterrenverpletterende botsingen op te nemen Laat langzaamgroeiende bossen herstellen voordat u opnieuw gaat kappen
Laat langzaamgroeiende bossen herstellen voordat u opnieuw gaat kappen Cellulose voor het vervaardigen van geavanceerde materialen
Cellulose voor het vervaardigen van geavanceerde materialen VW in Canada veroordeeld tot betaling van 196,5 miljoen dollar voor emissieschandaal
VW in Canada veroordeeld tot betaling van 196,5 miljoen dollar voor emissieschandaal Hoe ontstonden chemische bestanddelen die essentieel zijn voor het leven op de primitieve aarde?
Hoe ontstonden chemische bestanddelen die essentieel zijn voor het leven op de primitieve aarde?  zuidwesten, American Airlines duwt MAX-retour uit tot maart (update)
zuidwesten, American Airlines duwt MAX-retour uit tot maart (update) Uber schikt Nederlands onderzoek voor 2,3 miljoen euro
Uber schikt Nederlands onderzoek voor 2,3 miljoen euro Mexico verhoogt bescherming op pre-Spaanse ceremoniële site
Mexico verhoogt bescherming op pre-Spaanse ceremoniële site
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

