
Wetenschap
Werkingsmechanisme van cholecystokininereceptoren onthuld
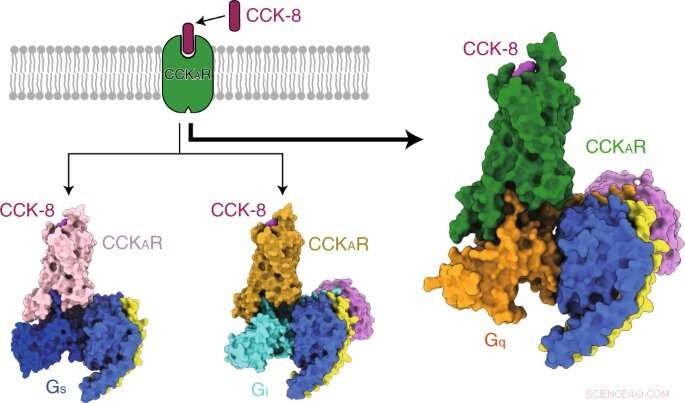
Grafisch abstract. Krediet:DOI:10.1038/s41589-021-00841-3
Cholecystokinine (CCK) en gastrine zijn de vroegst ontdekte gastro-intestinale hormonen. Het zijn de meest voorkomende peptiden in het maagdarmkanaal en het centrale zenuwstelsel, fungeren als fysiologisch belangrijke hormonen en neurotransmitters via twee CCK-receptorsubtypen, CCKAR en CCKBR.
Deze twee receptoren houden zich bezig met fundamentele fysiologische acties zoals verzadigingsregulatie, uitscheiding van pancreasenzymen, en galblaascontractie. Ze zijn ook betrokken bij gedragsprocessen, inclusief angst, geheugen, en drugsverslaving. Echter, de ontwikkeling van geneesmiddelen tegen cholecystokininereceptoren (CCKR's) is een uitdaging, voornamelijk vanwege het gebrek aan precieze structurele informatie.
In twee studies, beide gepubliceerd in Natuur Chemische Biologie , het onderzoeksteam onder leiding van Jiang Yi, Wang Mingwei, H. Eric Xu, Zhao Qiang, en Wu Beili van het Shanghai Institute of Materia Medica van de Chinese Academie van Wetenschappen en het onderzoeksteam onder leiding van Zhao Suwen van de ShanghaiTech University, onthulden samen de mechanismen van ligandherkenning, activering en G-eiwitkoppelingsspecificiteit van CCKR's.
De onderzoekers losten eerst drie kristalstructuren van de menselijke CCKAR op in complex met twee kleine-molecuul-antagonisten (lintitript en devazepide) en één volledige agonist NN9056, evenals vijf cryo-elektronenmicroscopie (cryo-EM) structuren van CCK-8 geactiveerde CCKAR in complex met drie G-eiwitten (Gi, g, en Gq) en gastrine geactiveerd CCKBR gekoppeld aan twee G-eiwitten (Gi en Gq). Ze verhelderden de mechanismen van CCKR-herkenning door liganden, CCKR's activering, en G-eiwit promiscuïteit van CCKAR, die allemaal fundamentele informatie verschaffen voor het ontdekken van geneesmiddelen van CCKR's.
De onderzoekers presenteerden vervolgens de structuren van gesulfateerd CCK-8 gebonden CCKAR in complex met Gq, g, en Gi heterotrimeren bij globale resoluties van 2,9 angstrom, 3.1 Angström, en 3,2 angström, respectievelijk. Ze ontdekten de bindingsmodus van endogeen peptide CCK-8, en vond dat de sulfo-tyrosine in CCK-8 cruciaal was voor de hoge affiniteit van endogeen peptide voor CCKAR.
Consequent, de onderzoekers ontdekten dat Gq-eiwit de meest krachtige koppelingsactiviteit van CCKAR vertoonde. Deze resultaten ondersteunden Gq als de overheersende transducer van CCKAR en benadrukten het belang van het interfacegebied in de selectiviteit van G-eiwitkoppeling.
Bovendien, de onderzoekers rapporteerden drie kristalstructuren van CCKAR gebonden aan kleine moleculaire antagonisten en een peptide-agonist, evenals twee cryo-EM-structuren van Gi- en Gq-gekoppelde CCKBR-complexen. Ze onthulden de bindingsmodus van CCKR's door zowel peptide- als kleinmoleculige liganden, en identificeerde cruciale rollen bij het herkennen van CCKAR door devazepide en lintitript, waardoor een sjabloon wordt geboden voor het ontwerpen van geneesmiddelen die gericht zijn op CCKR's.
Door de inactieve en actieve structuren van CCKAR te combineren met de moleculaire simulatieanalyse, de onderzoekers stelden het stapsgewijze activeringsproces van CCKAR voor.
De bevindingen van deze twee onderzoeken boden het eerste inzicht in ligandherkenning en activering van de twee CCK-receptoren en boden een nieuwe kans voor het ontwerpen van geneesmiddelen die gericht zijn op CCKR's.
 Pure angst:Louisiana zet zich schrap voor orkaandelta
Pure angst:Louisiana zet zich schrap voor orkaandelta Klimaatinformatie gebruiken om kwetsbare bevolkingsgroepen in Bangladesh te beschermen
Klimaatinformatie gebruiken om kwetsbare bevolkingsgroepen in Bangladesh te beschermen Veranderingen in niet-extreme neerslag kunnen minder subtiele gevolgen hebben
Veranderingen in niet-extreme neerslag kunnen minder subtiele gevolgen hebben 6 tools voor het voorspellen van sneeuwstormen om deze winter te gebruiken
6 tools voor het voorspellen van sneeuwstormen om deze winter te gebruiken Hoe te beginnen Zoetwater Garnalen Farming
Hoe te beginnen Zoetwater Garnalen Farming
Hoofdlijnen
- Belang van vrije ribosomen
- Een ingenieursgids voor het embryo
- Onderzoekers onthullen een faalveilige structuur van een enzym dat verband houdt met de ziekte van Alzheimer, kanker
- 10 misvattingen over de griep
- Het verschil tussen Anaphase, Interphase, Metaphase en Prophase
- Nieuwe statistische methode voor het evalueren van reproduceerbaarheid in studies van genoomorganisatie
- Elke zandkorrel is een metropool voor bacteriën
- Genetische instructies van moeder bepalen het patroon voor embryonale ontwikkeling
- Wat zijn Agar Slants?
- Hydrogel bevordert wondgenezing beter dan traditionele zwachtels, gaasjes
- Biologen ontdekken carotenoïdenoverdracht tussen twee eiwitten

- Het mysterie openbreken hoeveel bubbels er in een glas bier zitten

- Hoe de tijd berekenen om een object te verwarmen

- Een nieuwe manier om kleuremissies van transparante films te moduleren

 Onderzoekers demonstreren een nieuwe benadering voor het meten van de connectiviteit van hersenfuncties
Onderzoekers demonstreren een nieuwe benadering voor het meten van de connectiviteit van hersenfuncties Buzz groeit op vliegende auto's voorafgaand aan grote techshow
Buzz groeit op vliegende auto's voorafgaand aan grote techshow Frankrijk verbiedt vernietiging van onverkochte goederen gericht op Amazon, luxe merken
Frankrijk verbiedt vernietiging van onverkochte goederen gericht op Amazon, luxe merken Wanneer babyplaneten smelten:op zoek naar de geschiedenis van planetesimalen
Wanneer babyplaneten smelten:op zoek naar de geschiedenis van planetesimalen Vroegste mensen verbleven in het oudste hotel van Amerika in de Mexicaanse grot
Vroegste mensen verbleven in het oudste hotel van Amerika in de Mexicaanse grot Verschillende granulerende bindmiddelen
Verschillende granulerende bindmiddelen  Een getalenteerd 2D-materiaal krijgt een nieuw optreden
Een getalenteerd 2D-materiaal krijgt een nieuw optreden VK warmer en natter door klimaatverandering:studie
VK warmer en natter door klimaatverandering:studie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

