
Wetenschap
Hoe verschillen de formules van moleculaire en ionische verbindingen?
1. Samenstelling: Bestaat uit moleculen die worden gevormd door de chemische binding van atomen.
2. Formuleweergave: Gebruikt de chemische symbolen van de samenstellende elementen.
3. Formule-subscripts: Subscripts geven de relatieve verhoudingen van verschillende atomen binnen een molecuul aan. H2O vertegenwoordigt bijvoorbeeld een watermolecuul met twee waterstofatomen en één zuurstofatoom.
4. Formulekosten: Moleculaire verbindingen zijn over het algemeen neutraal, wat betekent dat ze geen algehele elektrische lading hebben. Daarom bevatten hun formules geen kosten.
Ionische verbindingen:
1. Samenstelling: Bestaat uit positief geladen ionen (kationen) en negatief geladen ionen (anionen) die bij elkaar worden gehouden door elektrostatische krachten.
2. Formuleweergave: Gebruikt de chemische symbolen van de samenstellende elementen en superscriptladingen om hun ionische ladingen aan te geven.
3. Formule-subscripts: Subscripten in formules van ionische verbindingen worden gebruikt om de ladingen van kationen en anionen in evenwicht te brengen om elektrische neutraliteit te bereiken. NaCl staat bijvoorbeeld voor natriumchloride, waarbij de +1 lading van Na+ de -1 lading van Cl- in evenwicht brengt.
4. Formulekosten: Ionische verbindingen hebben over het algemeen een neutrale lading, dus de som van de ladingen van de kationen moet gelijk zijn aan de som van de ladingen van de anionen in de formule.
Samenvattend liggen de belangrijkste verschillen tussen moleculaire en ionische samenstellingsformules in hun samenstelling, weergave van ladingen en doel van subscripts. Formules van moleculaire verbindingen vertegenwoordigen neutrale moleculen, terwijl formules van ionische verbindingen elektrisch neutrale combinaties van ionen vertegenwoordigen.
Hoofdlijnen
- G1-fase: wat gebeurt er tijdens deze fase van de celcyclus?
- Klimaatverandering zou de verspreiding van kwallen en ander gelatineus zoöplankton in de Noordelijke IJszee aanzienlijk kunnen veranderen
- Koel als ijs:hoe nieuw onderzoek wetenschappers helpt cellen te behouden
- Spanje kent persoonlijkheidsstatus toe aan bedreigde lagune
- Hoe vanilleteelt op de juiste plek loont voor mens en natuur
- Darmmicrobioom helpt beren met zeer verschillende diëten om dezelfde grootte te bereiken
- Hoe houdt de gentheorie verband met evolutie?
- Wat is apoptose?
- Hoe verklaren basenparingsregels hoe een DNA-streng tijdens replicatie als sjabloon fungeert?
- Gezien de impact van de chemiecocktail voor binnenshuis

- Experimenten op afstand tonen de waarde van wereldwijde verbindingen tijdens de pandemie

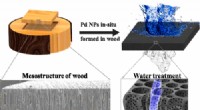
- Houtfilter verwijdert giftige kleurstof uit water
- Wetenschappers richten zich op kankerbehandelingen met CRISPR
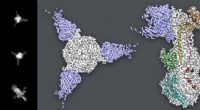
- Cryo-EM-studie levert nieuwe aanwijzingen op voor waterpokkeninfectie
 Gemakkelijke manieren om koper te smelten
Gemakkelijke manieren om koper te smelten Hoe hacken voorkomen? Lees dit verhaal en zet vervolgens uw computer uit
Hoe hacken voorkomen? Lees dit verhaal en zet vervolgens uw computer uit  Ga je verder? Opvattingen over sociale mobiliteit bepalen het geloof van Amerikanen in de status quo
Ga je verder? Opvattingen over sociale mobiliteit bepalen het geloof van Amerikanen in de status quo  Wat is de reactie tussen zuurstof en boor?
Wat is de reactie tussen zuurstof en boor?  Is NH4 plus een binaire verbinding?
Is NH4 plus een binaire verbinding?  VS-Europese satelliet maakt 's werelds eerste wereldwijde zoetwateronderzoek
VS-Europese satelliet maakt 's werelds eerste wereldwijde zoetwateronderzoek Klimaatverandering veroorzaakte dit jaar 15 rampen die meer dan $ 1 miljard hebben gekost:liefdadigheid
Klimaatverandering veroorzaakte dit jaar 15 rampen die meer dan $ 1 miljard hebben gekost:liefdadigheid Grote plannen om de planeet te redden zijn afhankelijk van nanoscopische materialen die de energieopslag verbeteren
Grote plannen om de planeet te redden zijn afhankelijk van nanoscopische materialen die de energieopslag verbeteren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


