
Wetenschap
Cryo-EM-studie levert nieuwe aanwijzingen op voor waterpokkeninfectie
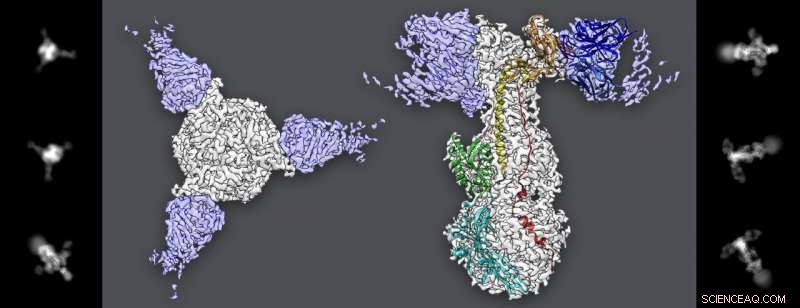
Afbeeldingen geëxtraheerd uit cryo-EM-gegevens (linker- en rechterpanelen) tonen het gB-eiwit van het varicella zoster-virus met drie antilichamen aan de uiteinden. Verschillende weergaven van het eiwit en de antilichamen samen werden gebruikt om hun moleculaire structuur te reconstrueren tot bijna atomaire resolutie. Krediet:Greg Stewart/SLAC National Accelerator Laboratory
Ondanks tientallen jaren van studie, precies hoe herpesvirussen onze cellen binnendringen, blijft een beetje een mysterie. Nu bestuderen onderzoekers één herpesvirus, het varicella zoster-virus (VZV) dat waterpokken veroorzaakt, heeft mogelijk een belangrijke aanwijzing gevonden:een sleuteleiwit dat het virus gebruikt om een infectie te initiëren, werkt niet zoals eerder werd gedacht, onderzoekers van Stanford University en het SLAC National Accelerator Laboratory van het Department of Energy rapporteren 18 augustus in Natuurcommunicatie .
De resultaten zijn mogelijk gemaakt door cryo-elektronenmicroscopie met hoge resolutie (cryo-EM), waaruit bleek dat het immuunsysteem infectie kan voorkomen door op een onverwachte plaats een plek op het eiwit aan te vallen, zei Stefan Oliver, een senior onderzoekswetenschapper in kindergeneeskunde aan Stanford en de eerste auteur van de nieuwe studie.
Herpesvirussen, waaronder VZV, samen met HIV, coronavirussen, en een aantal andere virusfamilies - zijn ingesloten in een beschermend membraan, en de eerste stap in het proces van het binnendringen van een cel is dat de virale envelop fuseert met het celmembraan. In het geval van VZV een eiwit genaamd gB dat aan de buitenkant van de virale envelop zit, gebruikt een reeks moleculaire vingers om cellen vast te grijpen en te fuseren met cellen.
Maar dat blijkt maar een deel van het verhaal te zijn. Om nader te onderzoeken wat er aan de hand was, Oliver en collega's gebruikten een antilichaam van een patiënt die VZV-fusie met cellen in cryo-EM-experimenten verhinderde om te ontdekken waar het antilichaam gB aanvalt.
Tot verbazing van Oliver en collega's, het antilichaam gebonden aan een plek op gB ver van de fusievingers, wat aangeeft dat het misschien niet nodig is om de vingers te richten om fusie met een cel te voorkomen. Dit resultaat suggereert dat er mogelijk meer betrokken is bij het fusieproces, die een infectie veroorzaakt, dan werd gerealiseerd.
Om uit te zoeken hoe het fusieproces precies werkt, zijn verdere studies nodig die het ontwerp van behandelingen en vaccins voor andere herpesvirussen kunnen informeren, Olivier zei, omdat ze ook afhankelijk zijn van gB om cellen te infecteren. "Vaccinaties zijn momenteel niet beschikbaar voor herpesvirussen, met uitzondering van degene die VZV verhindert, dus de ontwikkeling van vaccins die gericht zijn op deze nieuw geïdentificeerde regio van gB heeft het potentieel om een belangrijke medische behoefte op te lossen."
Oliver voegde toe, "Het was alleen mogelijk om dit mechanisme bloot te leggen door een van de structuren met de hoogste resolutie van een viraal eiwit-antilichaampaar te genereren met behulp van cryo-EM. Zonder de cryo-EM-mogelijkheden bij SLAC zouden deze fascinerende inzichten in de moleculaire mechanismen van de fusiefunctie niet hebben bestaan haalbaar was".
Hoofdlijnen
- Wat zijn fysieke kenmerken die worden doorgegeven van ouders?
- Wat is de Marshmallow-test en kunnen dieren deze doorstaan?
- Je lichaamscellen gebruiken en verzetten zich tegen kracht, en ze bewegen. Zijn mechanobiologie
- Onverwachte regulatie van transcriptiefactoren die cruciaal zijn voor ontwikkeling
- Wat gebeurt er op het chromosomale niveau als een resultaat van bevruchting?
- Glimlachende menselijke gezichten zijn aantrekkelijk voor honden - dankzij oxytocine
- Wrens-oproepen onthullen subtiele verschillen tussen ondersoorten
- Studie geeft inzicht in hoe algen kooldioxide uit de lucht zuigen
- Mannelijke dolfijnen bieden geschenken aan om vrouwtjes aan te trekken
- Chemici brachten gevouwen eiwitten tot leven

- Snelle en efficiënte scheiding van olie en water bereikt door nieuw ontwikkelde deeltjes

- Een gevaarlijk gif veranderen in een biosensor

- Doorbraak in het mengen van metalen - nauwkeurige controle van multimetallische clustervorming van één nanometer bereikt
- Gericht op verborgen zak voor behandeling van beroerte en epileptische aanvallen
 Hoe het volume van voids
Hoe het volume van voids Oud DNA vertelt het verhaal van de eerste herders en boeren in Oost-Afrika
Oud DNA vertelt het verhaal van de eerste herders en boeren in Oost-Afrika Projecten over de chemie in het dagelijks leven
Projecten over de chemie in het dagelijks leven  Nieuwe aanpak maakt het gemakkelijker om nieuwe medicijnen te vinden
Nieuwe aanpak maakt het gemakkelijker om nieuwe medicijnen te vinden Nieuwe tools verbeteren het nutriënten- en waterbeheer van de boerderij
Nieuwe tools verbeteren het nutriënten- en waterbeheer van de boerderij Telewerken blijkt weinig invloed te hebben op de carrières van bedrijven
Telewerken blijkt weinig invloed te hebben op de carrières van bedrijven Remming van de energietransmissie-impact van stofaërosolen op tropische cyclonen in het oosten van de Stille Oceaan
Remming van de energietransmissie-impact van stofaërosolen op tropische cyclonen in het oosten van de Stille Oceaan Werken op afstand verergert de ongelijkheid door vooral mensen met een hoog inkomen te helpen
Werken op afstand verergert de ongelijkheid door vooral mensen met een hoog inkomen te helpen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


