
Wetenschap
Wat gebeurt er met de PH-waarde van het reactiemengsel tijdens neutralisatie?
1. Oorspronkelijk:
- Voordat het zuur en de base worden gemengd, is de pH van het reactiemengsel afhankelijk van de uitgangsmaterialen:
- Als de oplossing een sterker zuur bevat, zal de pH lager (zuurrijker) zijn.
- Als de oplossing een sterkere base bevat, zal de pH hoger (basischer) zijn.
2. Mengen:
- Wanneer het zuur en de base worden gemengd, begint de reactie en beginnen de waterstofionen (H+) uit het zuur zich te combineren met de hydroxide-ionen (OH-) uit de base om water (H2O) te vormen.
3. pH-veranderingen:
- Naarmate de reactie vordert, neemt de concentratie van H+ en OH- ionen in de oplossing af. Deze daling zorgt ervoor dat de pH-waarde van het mengsel verschuift naar een neutrale waarde (pH =7).
- De pH zal geleidelijk stijgen als de oorspronkelijke oplossing zuur was (van lage pH naar 7) of dalen als deze basisch was (van hoge pH naar 7).
4. Eindpunt:
- Op een bepaald punt, het equivalentiepunt genoemd zullen de reactanten in stoichiometrisch gelijke hoeveelheden aanwezig zijn, en zal hun volledige neutralisatie plaatsvinden.
- Op dit punt zal de pH van de oplossing precies 7 zijn , wat een neutraal aangeeft oplossing.
5. Voorbij eindpunt:
- Als u meer zuur toevoegt nadat u het equivalentiepunt heeft bereikt, zorgen de H+-ionen uit het overtollige zuur ervoor dat de pH onder de 7 daalt, waardoor de oplossing weer zuur wordt.
- Op dezelfde manier zal het toevoegen van meer base na het equivalentiepunt de OH-concentratie verhogen, waardoor de pH boven 7 komt en de oplossing basisch wordt.
 Deoxygenatie van de oceaan:een stille aanjager van de ondergang van koraalriffen?
Deoxygenatie van de oceaan:een stille aanjager van de ondergang van koraalriffen? Het toevoegen van organische stof aan de bodem heeft een beperkt effect op het waterhoudend vermogen
Het toevoegen van organische stof aan de bodem heeft een beperkt effect op het waterhoudend vermogen Nieuwe studie onderzoekt federale buyouts van huiseigenaren
Nieuwe studie onderzoekt federale buyouts van huiseigenaren Stedelijke watersysteemtheorie 5.0 biedt een systematische oplossing voor complexe stedelijke watervraagstukken in China
Stedelijke watersysteemtheorie 5.0 biedt een systematische oplossing voor complexe stedelijke watervraagstukken in China  Welke knaagdieren leven in Colorado?
Welke knaagdieren leven in Colorado?
Hoofdlijnen
- Alle tanden en klauwen? Nieuw onderzoek werpt licht op de functie van dinosaurusklauwen
- Music Science Fair Project Ideas
- Waarom wordt gramkleuring meestal niet toegepast op eukaryoten?
- Verschillen tussen een neuron en een neuroglia
- Het idee testen dat milieu-uitdagingen de evolutie van grotere hersenen stimuleren
- Canadese kariboes, habitat blijft afnemen:rapport
- Mariene microplastics:hoe de verspreiding van watermassa de transporttrajecten beïnvloedt
- Waarom is een atom elektrisch neutraal?
- Meld-en-klauwzeer:de lacunes in de inspanningen van Zuid-Afrika om het onder controle te houden
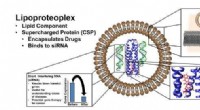
- Onderzoekers creëren biomateriaal dat zowel een krachtig medicijn als gendempers levert
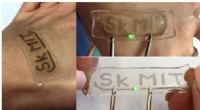
- Team ontwikkelt eenvoudige hydrogel-modificatiemethode voor rekbare en transparante elektronica
- Onderzoekers maken landingsbaan vrij voor op tin gebaseerde perovskiet-zonnecellen

- Zonne-energie omzetten in waterstofbrandstof, met hulp van fotosynthese

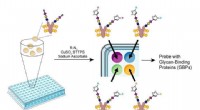
- Nieuwe TSRI-methode versnelt studies naar koolhydraatbiologie
 Nog een grimmig klimaatrapport over oceanen:wat is er nodig om de toenemende problemen aan te pakken?
Nog een grimmig klimaatrapport over oceanen:wat is er nodig om de toenemende problemen aan te pakken? Karakterisering van de structuur van zelfassemblerende organische moleculen op het oppervlak van nanodeeltjes
Karakterisering van de structuur van zelfassemblerende organische moleculen op het oppervlak van nanodeeltjes Wat waren de resultaten van zijn eerste experiment?
Wat waren de resultaten van zijn eerste experiment?  Een homing baken voor chemotherapie medicijnen
Een homing baken voor chemotherapie medicijnen Een frisse benadering van experimenteel ontwerp bij de SLAC-röntgenlaser
Een frisse benadering van experimenteel ontwerp bij de SLAC-röntgenlaser Japan keurt anti-plasticwet goed, maar zonder sancties voor vervuilers
Japan keurt anti-plasticwet goed, maar zonder sancties voor vervuilers Nieuwe sensor om atmosferische aerosolen en stikstofdioxide tegelijkertijd te meten
Nieuwe sensor om atmosferische aerosolen en stikstofdioxide tegelijkertijd te meten Wat zijn Prionen?
Wat zijn Prionen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

