
Wetenschap
Chemische reactie van ammoniak en HCl?
NH$_3$ + HCl → NH$_4$Cl
Bij deze reactie fungeert ammoniak als een base en accepteert een proton (H$^+$) uit zoutzuur, dat als een zuur werkt. Het proton uit HCl combineert met het eenzame elektronenpaar op het stikstofatoom van ammoniak en vormt het ammoniumion (NH$_4^+$). Het chloride-ion (Cl$^-$) uit HCl combineert met het ammoniumion om ammoniumchloride te vormen, een witte, kristallijne vaste stof.
De reactie tussen ammoniak en zoutzuur wordt doorgaans uitgevoerd in waterige oplossingen. De producten van de reactie, ammoniumchloride en water, zijn beide oplosbaar in water en blijven opgelost in de oplossing. De reactie is exotherm, wat betekent dat er warmte vrijkomt. De tijdens de reactie geproduceerde warmte helpt de reactie vooruit te helpen en resulteert in een snelle en volledige omzetting van de reactanten in producten.
De reactie tussen ammoniak en zoutzuur is een belangrijk chemisch proces met verschillende industriële toepassingen. Het wordt gebruikt bij de productie van meststoffen, zoals ammoniumnitraat en ammoniumsulfaat, die essentieel zijn voor de landbouw. Het wordt ook gebruikt bij de productie van farmaceutische producten, kleurstoffen en andere chemicaliën. Bovendien wordt de reactie gebruikt in afvalwaterzuiveringsinstallaties om zuur afvalwater te neutraliseren en ammoniak te verwijderen, wat schadelijk kan zijn voor het waterleven.
 Wat is de meest schadelijke vorm van diversiteitsverlies?
Wat is de meest schadelijke vorm van diversiteitsverlies?  Hoe de klimaatverandering te stoppen:zes manieren om de wereld een betere plek te maken
Hoe de klimaatverandering te stoppen:zes manieren om de wereld een betere plek te maken Dodental vulkaan loopt op door naschokken DR Congo
Dodental vulkaan loopt op door naschokken DR Congo Wetlands van New York City zijn mogelijk onwetende generator van broeikasgassen
Wetlands van New York City zijn mogelijk onwetende generator van broeikasgassen EU krijgt zware last van vervuiling:eerste normen voor vrachtwagens
EU krijgt zware last van vervuiling:eerste normen voor vrachtwagens
Hoofdlijnen
- Waarom gebaren we?
- Wat hebben rommelige gazons te maken met bijenvoer? Een deskundige legt het uit
- De verschillen tussen fotosynthese en ademhaling
- Een stap dichter bij het begrijpen waarom sommige hagedissen immuun zijn voor het gif van zwarte weduwen
- Uit onderzoek blijkt dat sommige bomen oververhit raken in warmere regenwouden
- Blueprint laat zien hoe planten een suikertransportbaan aanleggen
- Hoe een DNA-monster wordt verzameld en voorbereid voor onderzoek
- Hoe converteert ADP naar ATP?
- Onderzoekers stemmen af op eiwitparen:team kwantificeert hoe mutaties celsignalerende bacteriën beïnvloeden
- Herbestemming van dimethyloxalylglycine om het glutaminemetabolisme te remmen
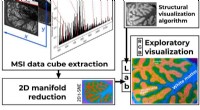
- Een nieuwe perceptueel consistente methode voor visualisatie van massaspectrometriebeeldvorming
- Neutronen maken analyse van ongebruikelijke eigenschappen van polymeergels mogelijk

- Chemicus maakt stoffen die de plantengroei stimuleren
- Kunststoffen en de vloek van duurzaamheid

 Hebben wangcellen membraangebonden organellen?
Hebben wangcellen membraangebonden organellen?  Nanofabricage met behulp van thermomechanische nanomolding
Nanofabricage met behulp van thermomechanische nanomolding  Onderzoek onderzoekt factoren van veerkrachtige stadsontwikkeling
Onderzoek onderzoekt factoren van veerkrachtige stadsontwikkeling  Onderzoek naar maïsgenetica onthult het mechanisme achter het stil worden van eigenschappen
Onderzoek naar maïsgenetica onthult het mechanisme achter het stil worden van eigenschappen Studie vindt delta helpt de impact van rivieroverstromingen te verminderen
Studie vindt delta helpt de impact van rivieroverstromingen te verminderen Raak niet in paniek:lessen geleerd van vals alarm in Hawaï
Raak niet in paniek:lessen geleerd van vals alarm in Hawaï Indringende vraag:Is een Stradivarius-viool beter dan andere violen?
Indringende vraag:Is een Stradivarius-viool beter dan andere violen?  Structureel inzicht in het moleculaire mechanisme van PET-degradatie
Structureel inzicht in het moleculaire mechanisme van PET-degradatie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

