
Wetenschap
Wat is de molverhouding van zout tot water in NA2SO4.10H2O?
1. Bepaal de molaire massa van \(Na_2SO_4.10H_2O\).
- De molaire massa van \(Na_2SO_4\) is ongeveer 142,04 g/mol.
- De molaire massa van \(H_2O\) is ongeveer 18,02 g/mol.
- De formule \(Na_2SO_4.10H_2O\) geeft aan dat er 10 moleculen water zijn voor elk molecuul \(Na_2SO_4\).
- Daarom is de molaire massa van \(Na_2SO_4.10H_2O\):
$$142,04 \text{ g/mol} \text{ (voor }Na_2SO_4) + 18,02 \text{ g/mol (voor 10 H}_2\text{O)} $$
$$142,04 \text{ g/mol} + 180,2 \text{ g/mol} $$
$$322,24 \text{ g/mol}$$
2. Bereken de molverhouding van zout tot water.
- De molverhouding van zout tot water is het aantal mol zout voor elke mol water in de verbinding.
- In \(Na_2SO_4.10H_2O\) is er één mol \(Na_2SO_4\) voor elke 10 mol \(H_2O\).
- De molverhouding van zout tot water is dus 1:10.
De molverhouding van zout tot water in \(Na_2SO_4.10H_2O\) is dus 1:10. Deze verhouding geeft aan dat er voor elke mol \(Na_2SO_4\) 10 mol watermoleculen geassocieerd zijn met het zout in deze gehydrateerde verbinding.
 Waarom zijn metalen flexibel?
Waarom zijn metalen flexibel?  Op algen geïnspireerde polymeren verlichten de weg voor verbeterd nachtzicht
Op algen geïnspireerde polymeren verlichten de weg voor verbeterd nachtzicht Hoe houtalcohol te maken door destillatie
Hoe houtalcohol te maken door destillatie Eénstapssynthese van Janus-hydrogel
Eénstapssynthese van Janus-hydrogel  Wat is het proces waarbij moleculen van een gebied met een hoge concentratie naar een gebied met een lage concentratie bewegen zonder de aanwezigheid van een membraan?
Wat is het proces waarbij moleculen van een gebied met een hoge concentratie naar een gebied met een lage concentratie bewegen zonder de aanwezigheid van een membraan?
 Tropische storm Faxai krijgt een naam en NASA krijgt een infraroodfoto
Tropische storm Faxai krijgt een naam en NASA krijgt een infraroodfoto NASA-onderzoek naar droogte toont de waarde van klimaatmitigatie aan, aanpassing
NASA-onderzoek naar droogte toont de waarde van klimaatmitigatie aan, aanpassing Trumps voorgestelde EPA-verlagingen zouden een onvoorstelbare impact hebben, volksgezondheidsdeskundige zegt:
Trumps voorgestelde EPA-verlagingen zouden een onvoorstelbare impact hebben, volksgezondheidsdeskundige zegt: In warmere klimaten, Groenlandse delta's zijn gegroeid, nieuwe analyse van 75 jaar oude luchtfoto's bevestigt
In warmere klimaten, Groenlandse delta's zijn gegroeid, nieuwe analyse van 75 jaar oude luchtfoto's bevestigt Enorme brand breekt uit bij olieraffinaderij Philadelphia
Enorme brand breekt uit bij olieraffinaderij Philadelphia
Hoofdlijnen
- Onderzoekers ontdekken details over hoe bacteriën beschermende barrières bouwen, wat nieuwe antibiotica kan opleveren
- 10 slechtste aanpassingen in het dierenrijk
- Oedogonium Life Cycle
- Algoritmen gebruiken om het complexe fonetische alfabet van potvissen te decoderen
- Waar is een cellulosespons van gemaakt?
- Slechte E. coli kennen we, maar goede coli?
- Welke structurele rol spelen fosfolipiden in cellen?
- Welk voedselmolecuul kan worden afgebroken om organismen van energie te voorzien?
- Vang me als je kunt:hoe mRNA-therapieën in cellen worden afgeleverd
- Sleutelenzym dat in planten wordt aangetroffen, kan de ontwikkeling van medicijnen en andere producten leiden
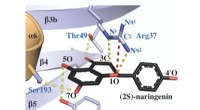
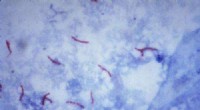
- Op papier gebaseerde tuberculosetest kan diagnoses in ontwikkelingslanden stimuleren
- Zonnewaterstof:Laten we eens kijken naar de stabiliteit van foto-elektroden

- Een thermometer die kan worden uitgerekt en vervormd door water
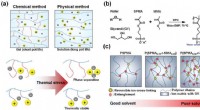
- Binnenkort biologisch afbreekbare teenslippers

 Nieuw exotisch materiedeeltje, een tetraquark, ontdekt
Nieuw exotisch materiedeeltje, een tetraquark, ontdekt Tien jaar na de enorme olieramp in de VS, angst voor offshore boren blijft bestaan
Tien jaar na de enorme olieramp in de VS, angst voor offshore boren blijft bestaan Ken je die 'regen'-geur? Het kan wetenschappers helpen bestuderen hoe geur gedrag beïnvloedt
Ken je die 'regen'-geur? Het kan wetenschappers helpen bestuderen hoe geur gedrag beïnvloedt  Duurzaamheid in de ruimte:kun je oude satellieten nieuwe trucjes leren?
Duurzaamheid in de ruimte:kun je oude satellieten nieuwe trucjes leren?  Onderzoekers ontwikkelen nieuwe sensor voor gemethyleerd DNA
Onderzoekers ontwikkelen nieuwe sensor voor gemethyleerd DNA Ben je gemaakt van ionische of covalente verbindingen?
Ben je gemaakt van ionische of covalente verbindingen?  LPG-verwarmingsgassen zijn lichter dan lucht?
LPG-verwarmingsgassen zijn lichter dan lucht?  Natuurkundigen onthullen hoe om te gaan met 'frustratie'
Natuurkundigen onthullen hoe om te gaan met 'frustratie'
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

