
Wetenschap
Sleutelenzym dat in planten wordt aangetroffen, kan de ontwikkeling van medicijnen en andere producten leiden
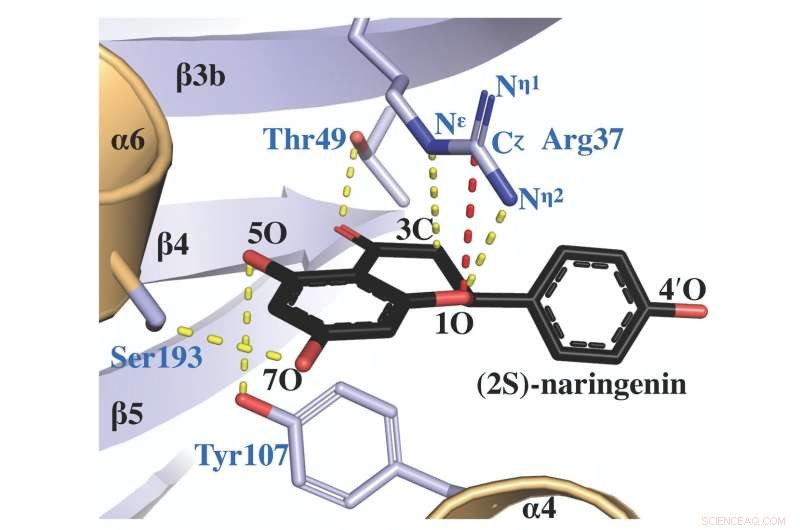
De eiwit X-ray kristalstructuur van chalcon isomerase, gecomplexeerd met een productmolecuul genaamd (2S)-naringenine, onthult hoe de actieve plaats arginine (aangeduid als Arg 37) de katalyse van het juiste isomeer vergemakkelijkt. Krediet:Salk Institute/ACS Catalysis
Planten kunnen veel geweldige dingen doen. Onder hun talenten, ze kunnen verbindingen maken die hen helpen ongedierte af te weren, bestuivers aantrekken, infecties genezen en zichzelf beschermen tegen te hoge temperaturen, droogte en andere gevaren in het milieu.
Onderzoekers van het Salk Institute die bestuderen hoe planten het vermogen hebben ontwikkeld om deze natuurlijke chemicaliën te maken, hebben ontdekt hoe een enzym genaamd chalcon-isomerase is geëvolueerd om planten in staat te stellen producten te maken die essentieel zijn voor hun eigen overleving. De onderzoekers hopen dat deze kennis de productie van producten zal helpen die gunstig zijn voor de mens, inclusief medicijnen en verbeterde gewassen. De studie is verschenen in de gedrukte versie van: ACS Katalyse op 6 sept. 2019.
"Sinds landplanten ongeveer 450 miljoen jaar geleden voor het eerst op aarde verschenen, ze hebben een geavanceerd metabolisch systeem ontwikkeld om koolstofdioxide uit de atmosfeer om te zetten in een groot aantal natuurlijke chemicaliën in hun wortels, scheuten en zaden, " zegt Salk Professor Joseph Noel, senior auteur van de krant. "Dit is het hoogtepunt van het werk dat we de afgelopen 20 jaar in mijn lab hebben gedaan, proberen de chemische evolutie van planten te begrijpen. Het geeft ons gedetailleerde kennis over hoe planten dit unieke vermogen hebben ontwikkeld om een aantal zeer ongebruikelijke maar belangrijke moleculen te maken."
Eerder onderzoek in het Noel-lab keek naar hoe deze enzymen evolueerden uit niet-enzymeiwitten, inclusief het bestuderen van meer primitieve versies ervan die voorkomen in organismen zoals bacteriën en schimmels.
Als een enzym, chalcon-isomerase werkt als een katalysator om chemische reacties in planten te versnellen. Het helpt ook om ervoor te zorgen dat de chemicaliën die in de plant worden gemaakt de juiste vorm hebben, omdat moleculen met dezelfde chemische formule twee verschillende variaties kunnen aannemen die spiegelbeelden van elkaar zijn (isomeren genoemd).

Salk-professor Joseph Noel, afgebeeld in zijn lab, naast een NMR-spectroscopiemachine, die wordt gebruikt om de details van de elektronische structuren van moleculen te ontcijferen. Krediet:Salk Institute
"In de farmaceutische industrie het is belangrijk dat de medicijnen die worden gemaakt de juiste versie zijn, of isomeer, omdat het gebruik van de verkeerde kan leiden tot onbedoelde bijwerkingen, " zegt Noël, die directeur is van Salk's Jack H. Skirball Center for Chemical Biology and Proteomics en de Arthur en Julie Woodrow-leerstoel bekleedt. "Door te bestuderen hoe chalcon-isomerase werkt, we kunnen meer leren over hoe we de productie van de juiste isomeren van geneesmiddelen en andere producten die belangrijk kunnen zijn voor de menselijke gezondheid kunnen versnellen."
In de huidige studie, de onderzoekers gebruikten verschillende structurele biologietechnieken om de unieke vorm van het enzym te onderzoeken en hoe de vorm verandert als het interageert met andere moleculen. Ze hebben het deel van de structuur van chalcon-isomerase vastgesteld waardoor het reacties ongelooflijk snel kon katalyseren en er tegelijkertijd voor zorgde dat het de juiste, biologisch actieve isomeer. Deze reacties leiden tot tal van activiteiten in planten, inclusief het omzetten van primaire metabolieten zoals fenylalanine en tyrosine in vitale gespecialiseerde moleculen die flavonoïden worden genoemd.
Het bleek dat een bepaald aminozuur, arginine, dat was een van de vele aminozuren die aan elkaar waren gekoppeld in chalcon-isomerase op een locatie, gevormd door evolutie, waardoor het de sleutelrol speelde in de manier waarop chalcon-isomerasereacties werden gekatalyseerd.
"Door structurele studies en computermodellering te doen, we konden de zeer precieze posities van arginine in de actieve plaats van het enzym zien naarmate de reactie vorderde, " zegt eerste auteur Jason Burke, een voormalig postdoctoraal onderzoek in het laboratorium van Noel, die nu een assistent-professor is aan de California State University San Bernardino. "Zonder die arginine, het werkt niet op dezelfde manier."
Burke voegt eraan toe dat dit type katalysator al lang gezocht wordt door organische chemici. "Dit is een voorbeeld van hoe de natuur al een probleem oplost waar scheikundigen al lang naar kijken, " hij voegt toe.
"Door chalcon-isomerase te begrijpen, we kunnen een nieuwe toolset maken die scheikundigen kunnen gebruiken voor de reacties die ze bestuderen, Noel zegt. "Het is absoluut essentieel om dit soort fundamentele kennis te hebben om moleculaire systemen te kunnen ontwerpen die een bepaalde taak kunnen uitvoeren, zelfs in de volgende generatie van voedingsrijke gewassen die in staat zijn het broeikasgas koolstofdioxide om te zetten in moleculen die essentieel zijn voor leven."
Hoofdlijnen
- Paradoxen in microbiële economieën
- Graslandmussen constant op zoek naar een mooier huis
- De mens als model voor het begrijpen van biologische fundamenten
- Begrijpen? Je hersensignalen zullen het vertellen
- Hoe telomeren werken
- Oudste Homo Sapiens-fossielen die ooit zijn gevonden, suggereren een herschrijving van menselijke evolutie
- Vergelijk en contrast kunstmatige en natuurlijke selectie
- Bodembedekkers bieden een bed &breakfast-tussenstop voor trekvogels
- Welke drie organellen hebben DNA?
- Een nieuwe methode kan tomaten veiliger maken om te eten

- Nieuw inzicht in een kankerbeschermend eiwit kan leiden tot een nieuwe generatie kankerbehandelingen
- Wetenschappers zorgen voor metingen met hoge resolutie voor koolstofdiplomatie

- Onderzoekers ontwikkelen een efficiënte, energiezuinige methode voor het upcyclen van polyethyleen plastic afval tot waardevolle moleculen

- Speekseltest voor cannabis kan ooit helpen bij het identificeren van gehandicapte bestuurders

 Katalysatoronderzoek voor zonnebrandstoffen:amorf molybdeensulfide werkt het beste
Katalysatoronderzoek voor zonnebrandstoffen:amorf molybdeensulfide werkt het beste Science Projects on Bubbleology
Science Projects on Bubbleology Verbeterde siliciumtechnologie met grafeen en 2D-materialen
Verbeterde siliciumtechnologie met grafeen en 2D-materialen Hoe kunnen we voorkomen dat de mensheid stagneert?
Hoe kunnen we voorkomen dat de mensheid stagneert? Onderzoekers combineren röntgenstralen en laserlicht tot beeldsprays
Onderzoekers combineren röntgenstralen en laserlicht tot beeldsprays Ringvormige multi-koolstofverbinding cyclocarbon gesynthetiseerd
Ringvormige multi-koolstofverbinding cyclocarbon gesynthetiseerd Cryo-EM-structuren van de nicotinereceptor kunnen leiden tot nieuwe therapieën voor verslaving
Cryo-EM-structuren van de nicotinereceptor kunnen leiden tot nieuwe therapieën voor verslaving ExoMars ziet unieke groene gloed op de Rode Planeet
ExoMars ziet unieke groene gloed op de Rode Planeet
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


