
Wetenschap
Wat zijn waterstofoxidatiegetallen?
Waterstof heeft gewoonlijk een oxidatiegetal van +1, omdat het één elektron verliest en een waterstofkation (H+) wordt. In sommige gevallen kan waterstof echter ook een oxidatiegetal van -1 hebben, zoals in metaalhydriden, waar het één elektron krijgt om een hydride-anion (H-) te worden. Het oxidatiegetal van waterstof wordt bepaald door de chemische omgeving en de elektronegativiteit van de atomen waaraan het gebonden is.
 Kleurstoffen detecteren ziekte door hartslagsignalen
Kleurstoffen detecteren ziekte door hartslagsignalen Heeft isopropylalcohol een grotere intermoleculaire kracht dan water?
Heeft isopropylalcohol een grotere intermoleculaire kracht dan water?  Voorspelling van de vervorming en prestaties van onderdelen gemaakt door additieve fabricage
Voorspelling van de vervorming en prestaties van onderdelen gemaakt door additieve fabricage Wegwerpmaskers kunnen worden gebruikt om beton te verbeteren
Wegwerpmaskers kunnen worden gebruikt om beton te verbeteren Onderzoekers passen ionenzachte landingstechniek toe voor vooruitgang in materiaalsynthese
Onderzoekers passen ionenzachte landingstechniek toe voor vooruitgang in materiaalsynthese
 Waarom zijn groene planten belangrijk voor het milieu?
Waarom zijn groene planten belangrijk voor het milieu?  NASA tropische storm Erick versterkt
NASA tropische storm Erick versterkt Kan een verenigd pad voor ontwikkeling en behoud tot een betere toekomst leiden?
Kan een verenigd pad voor ontwikkeling en behoud tot een betere toekomst leiden?  Sterkste aardbeving in 20 jaar rammelt Zuid-Californië (update)
Sterkste aardbeving in 20 jaar rammelt Zuid-Californië (update) Rusland zegt brandstof te hebben verwijderd uit rivier getroffen door Arctische lekkage
Rusland zegt brandstof te hebben verwijderd uit rivier getroffen door Arctische lekkage
Hoofdlijnen
- Heeft een virus DNA?
- Oorsprong van het leven? Ontdekking zou kunnen helpen verklaren hoe de eerste organismen op aarde ontstonden
- Wat is het belang van cross-over in procesevolutie?
- Verplichte etikettering op genetisch gemanipuleerde voedingsmiddelen kan de aankopen van klanten verminderen
- Onderzoekers geven aanwijzingen over hoe mosselen werken
- Onderzoekers testen intelligentie van Afrikaanse grijze papegaai
- Zullen tropische bergboomsoorten zich aanpassen aan de opwarming?
- Septate versus niet-Septate Hyphae
- Lantaarnvissen onthullen hoe de opwarming van de oceaan de schemerzone beïnvloedt
- Onderzoekers ontwikkelen een optische vezel gemaakt van gel afgeleid van zeealgen

- Wetenschappers ontwikkelen moleculaire visserij om individuele moleculen in bloed te vinden
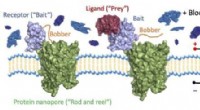
- Monitoring van de lichaamsvetverbranding door ademmonsters te nemen

- Meten van kleine krachten die tot grote effecten leiden

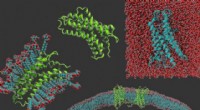
- Wetenschappers veranderen membraaneiwitten om ze gemakkelijker te bestuderen
 Wat hebben de wolkentoppen van Uranuss gemeen met rotte eieren?
Wat hebben de wolkentoppen van Uranuss gemeen met rotte eieren? Het communiceren van wetenschap kan er baat bij hebben dat wetenschappers mens zijn
Het communiceren van wetenschap kan er baat bij hebben dat wetenschappers mens zijn Waarom hebben cellen verschillende vormen en uiterlijk?
Waarom hebben cellen verschillende vormen en uiterlijk?  Wat is er zo speciaal aan een dinosaurus genaamd Leonardo?
Wat is er zo speciaal aan een dinosaurus genaamd Leonardo?  Mijnvijvers versterken kwikrisico's in Perus Amazon
Mijnvijvers versterken kwikrisico's in Perus Amazon Hoe een batterij te maken met Coke & Vinegar
Hoe een batterij te maken met Coke & Vinegar NASA's OCO-3 meet hoe planten groeien - en gloeien
NASA's OCO-3 meet hoe planten groeien - en gloeien Wat zijn verschillende soorten blizzards?
Wat zijn verschillende soorten blizzards?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

