
Wetenschap
Wat is zuurder benzoëzuur of o-acetylbenzoëzuur?
De acetylgroep (-COCH3) in o-acetylbenzoëzuur is een elektronenzuigende groep. Het onttrekt elektronen aan de benzeenring, waardoor het waterstofatoom op de carbonzuurgroep zuurder wordt. Dit betekent dat o-acetylbenzoëzuur gemakkelijker zijn waterstofion (H+) zal verliezen, wat resulteert in een lagere pH.
Benzeenzuur heeft daarentegen geen elektronenzuigende groepen op de benzeenring. Dit betekent dat het waterstofatoom op de carbonzuurgroep minder zuur is en dat benzoëzuur zijn waterstofion niet zo gemakkelijk zal verliezen als o-acetylbenzoëzuur. Als gevolg hiervan zal benzoëzuur een hogere pH hebben.
Het verschil in zuurgraad tussen benzoëzuur en o-acetylbenzoëzuur is te zien aan hun pKa-waarden. De pKa van benzoëzuur is 4,20, terwijl de pKa van o-acetylbenzoëzuur 3,45 is. De lagere pKa-waarde van o-acetylbenzoëzuur geeft aan dat het zuurder is dan benzoëzuur.
 Wat gebeurt er als een proton aan koolstof wordt toegevoegd?
Wat gebeurt er als een proton aan koolstof wordt toegevoegd?  Designer-peptiden vertonen potentieel voor het blokkeren van virussen, toekomstige studie aanmoedigen
Designer-peptiden vertonen potentieel voor het blokkeren van virussen, toekomstige studie aanmoedigen Wat is de chemische vergelijking voor fotolyse?
Wat is de chemische vergelijking voor fotolyse?  Een gasmonster wordt op constante temperatuur gehouden. Wat gebeurt er met de druk als het volume verdubbelt en het aantal moleculen verdubbelt?
Een gasmonster wordt op constante temperatuur gehouden. Wat gebeurt er met de druk als het volume verdubbelt en het aantal moleculen verdubbelt?  Hoe reinigt wasmiddel oppervlaktespanning?
Hoe reinigt wasmiddel oppervlaktespanning?
Hoofdlijnen
- Hoe ziet de reparatiewerkplaats van DNA eruit? Nieuw onderzoek identificeert de tools
- India verwelkomt cheeta's terug, 70 jaar na lokale uitsterving
- Hoe noem je een plant die voedsel voor zichzelf maakt?
- Roze + roze =goud? De veren van hybride kolibries komen niet overeen met die van zijn ouders
- Samengestelde gezichten van DNA helpen bij het oplossen van koude gevallen
- Hogere temperaturen maken het lastig voor vijgenboombestuivers
- Kopiëren of innoveren? Studie werpt licht op chimpanseecultuur
- Tropische diversiteit wortelt in relaties tussen schimmels en zaden
- Wat is de semantische organisatie van de menselijke taal?
- Technologie voor het produceren van aluminium matrixcomposieten uit nieuwe grondstoffen

- Wetenschappers ontdekken het upcyclen van plastic om de uitstoot van broeikasgassen te verminderen
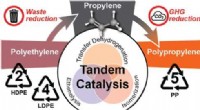
- Onderzoekers maken röntgenfoto's van accu's van elektrische voertuigen terwijl ze na verloop van tijd verslechteren

- Evolutie hacken, screeningstechniek kan het meest wijdverbreide enzym verbeteren

- Computermodel met hoge doorvoer voorspelt diffusiegegevens voor het transport van lichte elementen in vaste stoffen

 Langdurige houtkapstudie toont de effecten op chimpansees en gorilla's in de Republiek Congo aan
Langdurige houtkapstudie toont de effecten op chimpansees en gorilla's in de Republiek Congo aan De bizarre wereld van topologische materialen
De bizarre wereld van topologische materialen Hoe dierlijke voetafdrukken te identificeren
Hoe dierlijke voetafdrukken te identificeren Omgaan met stressvolle organisatieveranderingen
Omgaan met stressvolle organisatieveranderingen Universitaire teams met tijdschriftuitgever om manipulatie van citaten op te sporen en te voorkomen
Universitaire teams met tijdschriftuitgever om manipulatie van citaten op te sporen en te voorkomen Wat is een goed voorbeeld van een carbonylgroep?
Wat is een goed voorbeeld van een carbonylgroep?  Wetenschappers kweken koolstofnanobuisjesbos veel langer dan enig ander
Wetenschappers kweken koolstofnanobuisjesbos veel langer dan enig ander Wat is een alkalimengsel?
Wat is een alkalimengsel?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

