
Wetenschap
Hoeveel waterstofmoleculen zijn er nodig om 525 gram ammoniak te produceren?
N2 + 3 H2 → 2 NH3
Om het aantal benodigde waterstofmoleculen te berekenen, moeten we het aantal geproduceerde mol ammoniak bepalen en vervolgens de stoichiometrie van de reactie gebruiken om het aantal benodigde mol waterstof te berekenen.
Stap 1:Bereken het aantal geproduceerde mol ammoniak
De molaire massa van ammoniak (NH3) is 17,04 g/mol. Daarom is het aantal geproduceerde mol ammoniak:
$$\text{Mollen van NH}_3$$=\frac{\text{Massa van NH}_3}{\text{Molar massa van NH}_3}$$
$$=\frac{525 \text{ g}}{17.04 \text{ g/mol}}$$
$$=30,78 \text{ mol}$$
Stap 2:Bereken het benodigde aantal mol waterstof
Volgens de uitgebalanceerde chemische vergelijking zijn er 3 mol waterstof (H2) nodig om 2 mol ammoniak te produceren. Daarom is het benodigde aantal mol waterstof:
$$\text{Mollen van H}_2$$=\frac{3\text{ mol H}_2}{2\text{ mol NH}_3}\times \text{Mollen van NH}_3$$
$$=\frac{3\text{ mol H}_2}{2\text{ mol NH}_3}\times 30,78 \text{ mol}$$
$$=46,17 \text{ mol}$$
Stap 3:Bereken het aantal waterstofmoleculen
Aangezien 1 mol van welk gas dan ook $$6.022\times10^{23} \text{ moleculen }$$ bevat, is het benodigde aantal waterstofmoleculen:
Aantal H2-moleculen =$$ \text{Mollen van H}_2\times\text{ Avogadro's getal}$$
$$=46,17\text{ mol} \times 6,022\times10^{23} \text{ moleculen/mol}$$
$$=2,78 \times 10^{25} \text{ moleculen}$$
Daarom zijn er 2,78 x 10^25 waterstofmoleculen nodig om 525 gram ammoniak te produceren.
 Is broom een covalente of ionische verbinding?
Is broom een covalente of ionische verbinding?  Implanteerbaar piëzo-elektrisch polymeer verbetert gecontroleerde afgifte van medicijnen
Implanteerbaar piëzo-elektrisch polymeer verbetert gecontroleerde afgifte van medicijnen Hoeveel chemische bindingen zijn er in één molecuul pyrodruivenzuur?
Hoeveel chemische bindingen zijn er in één molecuul pyrodruivenzuur?  Google DeepMind voegt bijna 400.000 nieuwe verbindingen toe aan de open-access database
Google DeepMind voegt bijna 400.000 nieuwe verbindingen toe aan de open-access database  Zijn alle metalen glanzend en in vaste vorm?
Zijn alle metalen glanzend en in vaste vorm?
Hoofdlijnen
- Hoe de circadiane cyclus de reactie op medicijnen in planten beïnvloedt
- Onderzoek laat zien hoe slijm microben temt
- Waarom krult je haar in de zomer? Een scheikundige legt de wetenschap achter structuur uit
- Hoe markergenen in celclusters te vinden
- Naburige celtypes beïnvloeden de variabiliteit van genexpressie in één cel
- Nieuw onderzoek identificeert een gebrek aan geschikte bestrijdingsmiddelen voor veel belangrijke infectieziekten bij dieren
- Wat zijn de wortelstructuren?
- Wat kunnen planten leren van algen?
- Waarom je je kat moet trainen en hoe je dit moet doen
- Kunststof van hout? Röntgenanalyse wijst de weg naar op lignine gebaseerde componenten op maat
- Fusion-wetenschappers hebben een sculptuurtechniek op nanoschaal ontwikkeld
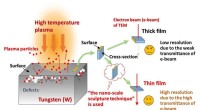
- Ontdekking van een nieuwe wet van fasescheiding

- Onderzoekers maken alcohol uit het niets
- Een kunstmatige tong van goud om ahornsiroop te proeven

 Hete en droge omstandigheden in het VK veroorzaken ongekend extreem natuurbrandgevaar
Hete en droge omstandigheden in het VK veroorzaken ongekend extreem natuurbrandgevaar Waarom zijn er zo weinig vrouwelijke CEO’s?
Waarom zijn er zo weinig vrouwelijke CEO’s?  Eenstapssynthese van efficiënte rode emitterende koolstofstippen voor in vivo bioimaging
Eenstapssynthese van efficiënte rode emitterende koolstofstippen voor in vivo bioimaging Verbeterd snoeien van bomen vermindert stormgerelateerde stroomuitval, studie vondsten
Verbeterd snoeien van bomen vermindert stormgerelateerde stroomuitval, studie vondsten Wetenschappers demonstreren eerste kleurafstembare en eerste op grafeen gebaseerde LED
Wetenschappers demonstreren eerste kleurafstembare en eerste op grafeen gebaseerde LED Zijn de duinen van Titan gemaakt van kometenstof?
Zijn de duinen van Titan gemaakt van kometenstof?  Voelen mannen en vrouwen pijn anders?
Voelen mannen en vrouwen pijn anders?  Bayer snijdt 12 af, 000 banen na overname Monsanto
Bayer snijdt 12 af, 000 banen na overname Monsanto
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

