
Wetenschap
Implanteerbaar piëzo-elektrisch polymeer verbetert gecontroleerde afgifte van medicijnen
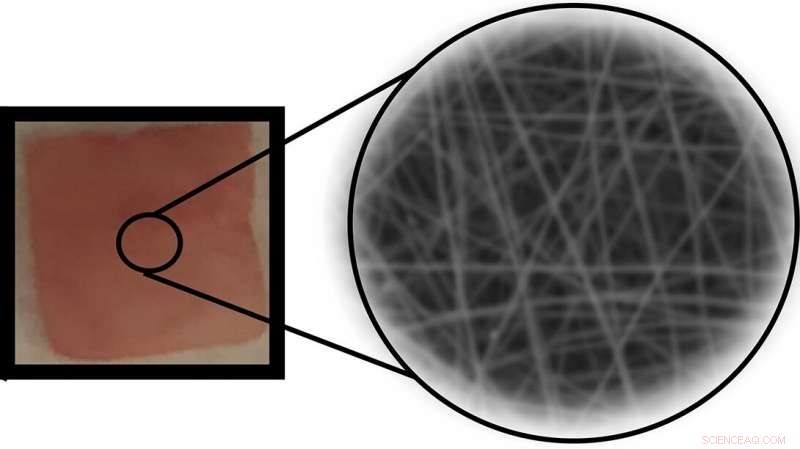
Een implanteerbaar piëzo-elektrisch polymeer nanovezelapparaat dat gecontroleerde hoeveelheden van een medicijn onder mechanische kracht afgeeft. Krediet:Jin Nam/UCR
Een membraan gemaakt van draden van een polymeer dat gewoonlijk wordt gebruikt in vaathechtingen, kan worden geladen met therapeutische geneesmiddelen en in het lichaam worden geïmplanteerd, waar mechanische krachten het elektrische potentieel van het polymeer activeren en de medicijnen langzaam afgeven.
Het nieuwe systeem, ontwikkeld door een groep onder leiding van bio-ingenieurs van UC Riverside en gepubliceerd in ACS toegepaste biomaterialen , overwint de grootste beperkingen van conventionele medicijntoediening en sommige methoden voor gecontroleerde afgifte, en zou de behandeling van kanker en andere chronische ziekten kunnen verbeteren.
De nadelen van conventionele toediening van geneesmiddelen zijn onder meer herhaalde toediening, niet-specifieke biodistributie in de lichaamssystemen, de langdurige onhoudbaarheid van medicijnmoleculen, en hoge cytotoxiciteit, vormt een uitdaging voor de efficiënte behandeling van chronische ziekten die in de loop van de tijd verschillende medicijndoseringen vereisen voor een optimale therapeutische werkzaamheid. De meeste methoden voor gecontroleerde afgifte kapselen geneesmiddeldeeltjes in biologisch afbreekbare, bubbelachtige containers die na verloop van tijd oplossen om het medicijn vrij te geven, waardoor het moeilijk wordt om medicijnen volgens een schema af te leveren. Anderen hebben betrekking op een apparaat op batterijen dat niet biocompatibel is.
Jin Nam, een universitair hoofddocent bio-engineering aan het Marlan en Rosemary Bourns College of Engineering van UC Riverside, runt een laboratorium dat werkt met biocompatibele polymeren om raamwerken te bouwen die bekend staan als scaffolds die stamcellen helpen weefsels en organen te herstellen. Een van deze polymeren, poly(vinylideenfluoride-trifluorethyleen), of P(VDF-TrFE), kan een elektrische lading produceren onder mechanische belasting. Nam realiseerde deze eigenschap, bekend als piëzo-elektriciteit, maakte het polymeer een potentieel levensvatbare kandidaat voor een geneesmiddelafgiftesysteem.
Zijn team gebruikte een techniek genaamd electrospinning om P(VDF-TrFE) nanovezels te produceren, gelaagd in een dunne mat. Door het materiaal op nanoschaal te structureren door middel van elektrospinnen, werd de gevoeligheid van de resulterende nanovezels geoptimaliseerd, zodat het medicijnafgiftesysteem zou reageren op fysiologisch veilige grootheden van kracht terwijl het ongevoelig bleef voor dagelijkse activiteiten. Door het grote oppervlak van de nanovezels konden ze een relatief grote hoeveelheid medicijnmoleculen adsorberen.
Nadat de film is ingebed in een hydrogel die levend weefsel nabootst, een reeks tests waarbij therapeutische schokgolven werden gebruikt, wekte voldoende elektrische lading op om een elektrostatisch bevestigd modelgeneesmiddelmolecuul in de omringende gel af te geven. De onderzoekers konden de hoeveelheid medicijnafgifte afstemmen door de uitgeoefende druk en duur te variëren.
"Dit piëzo-elektrische op nanovezels gebaseerde medicijnafgiftesysteem maakt gelokaliseerde levering van medicijnmoleculen op aanvraag mogelijk, die nuttig zou zijn voor ziekten of aandoeningen die langdurige, herhaalde toediening van medicijnen, zoals kankerbehandelingen, " zei Nam. "De grote oppervlakte-tot-volumeverhouding van de nanovezelstructuur maakt een grotere medicijnbelading mogelijk, wat leidt tot een enkele injectie of implantatie die langer duurt dan conventionele medicijnafgifte."
Vergeleken met traditionele medicijnafgiftesystemen op basis van degradatie of diffusieafgifte, die doorgaans een initiële burst-afgifte vertonen, gevolgd door verschillende afgiftesnelheden, het lineaire profiel van medicijnafgifte uit het piëzo-elektrische systeem maakt de nauwkeurige toediening van medicijnmoleculen mogelijk, ongeacht de implantatieduur. Herhaalde on-demand afgiftetests lieten een vergelijkbare hoeveelheid afgifte van het geneesmiddel per activering zien, bevestiging van de robuuste controle van de afgiftesnelheid.
De gevoeligheid van de kinetiek van medicijnafgifte kan worden afgestemd door de nanovezelgrootte te regelen tot een bereik dat wordt geactiveerd door therapeutische schokgolven, vaak gebruikt voor musculoskeletale pijnbehandeling met een handheld-apparaat. Kleiner, gevoeligere nanovezelformaten kunnen worden gebruikt voor implantatie in diepe weefsels, zoals in de buurt van een bot onder spieren, terwijl minder gevoelige grotere nanovezels kunnen worden gebruikt in subcutane toepassingen om valse activering door onbedoelde impact te voorkomen.
 Interfacing met de hersenen
Interfacing met de hersenen Milieuvriendelijke chemicaliën kunnen de verwerking van mineralen zelfs verbeteren
Milieuvriendelijke chemicaliën kunnen de verwerking van mineralen zelfs verbeteren Nieuwe techniek kan voorheen niet-detecteerbare bacteriën aan het licht brengen op plaatsen waar ze niet gewenst zijn
Nieuwe techniek kan voorheen niet-detecteerbare bacteriën aan het licht brengen op plaatsen waar ze niet gewenst zijn Hoe de gebalanceerde chemische reactie voor het roesten van Iron
Hoe de gebalanceerde chemische reactie voor het roesten van Iron Hoe maak je een 3D-model van een koolstof-atoom
Hoe maak je een 3D-model van een koolstof-atoom
 India's vuurwerkcentrum getroffen door anti-vervuilingsactie
India's vuurwerkcentrum getroffen door anti-vervuilingsactie Wijken met een laag inkomen zouden het meest profiteren van groene daken in steden als Chicago
Wijken met een laag inkomen zouden het meest profiteren van groene daken in steden als Chicago De offshore-olieplatforms van Californië zijn tientallen jaren oud, en de industrie verzet zich tegen de ontmanteling ervan
De offshore-olieplatforms van Californië zijn tientallen jaren oud, en de industrie verzet zich tegen de ontmanteling ervan Wat zijn de drie meest overvloedige gassen in de atmosfeer van de aarde?
Wat zijn de drie meest overvloedige gassen in de atmosfeer van de aarde?  De e-waste recyclingcrisis in India aanpakken
De e-waste recyclingcrisis in India aanpakken
Hoofdlijnen
- Kunnen we een echt Jurassic Park creëren?
- Stichting om speciaal reservaat te creëren voor albino orang-oetan
- Herintroductie van inheemse zoogdieren helpt dorre landschappen te herstellen
- Bronnen van het lactase-enzym
- 25 nieuwe genomen om 25 jaar Sanger Institute te vieren
- Waarom is fotosynthese belangrijk voor mensen?
- Wat is het verschil tussen continue en discontinue DNA-synthese?
- Voorbeelden van stoffen die gefaciliteerde diffusie gebruiken
- Wat zijn de vijf klassen van immunoglobulinen?
- Moleculaire spectroscopie gebruiken om reactiemechanismen te bestuderen

- Hoe elektrische velden een moleculaire draaiing in lichtgevoelige eiwitten beïnvloeden
- Video:Is uw katalysator gestolen? Dit is waarom

- Vormverschuivend materiaal kan morphen, keert zichzelf om met behulp van warmte, licht

- Analyseren van de voor- en nadelen van twee composietproductiemethoden

 Onderzoekers in Japan ontdekken fossiel van vogels uit het vroege Krijt
Onderzoekers in Japan ontdekken fossiel van vogels uit het vroege Krijt Noordse landen roepen op tot wereldwijd verdrag tegen plasticvervuiling in de oceaan
Noordse landen roepen op tot wereldwijd verdrag tegen plasticvervuiling in de oceaan Oude bergen vastgelegd in Antarctische zandsteen onthullen mogelijke verbanden met wereldwijde gebeurtenissen
Oude bergen vastgelegd in Antarctische zandsteen onthullen mogelijke verbanden met wereldwijde gebeurtenissen Hoe maak je een vermenigvuldiging Math Game met een spelbord
Hoe maak je een vermenigvuldiging Math Game met een spelbord  Australië signalen verschuiving weg van bedrog met klimaatkrediet
Australië signalen verschuiving weg van bedrog met klimaatkrediet Gesteentemonsters geven aan dat water een belangrijk ingrediënt is voor korstvorming
Gesteentemonsters geven aan dat water een belangrijk ingrediënt is voor korstvorming Informatie over de Exide GC135-batterij
Informatie over de Exide GC135-batterij  Wat zijn de voordelen van HPLC over GC?
Wat zijn de voordelen van HPLC over GC?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

