
Wetenschap
Aan welke soort reacties neemt zuurstof deel?
1. Verbrandingsreacties:Zuurstof is essentieel voor verbrandingsreacties, waarbij een brandstof snel wordt geoxideerd, waarbij energie vrijkomt in de vorm van warmte en licht. Wanneer we bijvoorbeeld hout of benzine verbranden, reageert zuurstof met de componenten van de brandstof (bijvoorbeeld cellulose, koolwaterstoffen) om koolstofdioxide (CO2), waterdamp (H2O) en energie te produceren.
2. Oxidatiereacties:Zuurstof ondergaat gemakkelijk oxidatie-reductie (redox) reacties, waarbij het werkt als een oxidatiemiddel (elektronenacceptor). Roesten van ijzer is een veelvoorkomend voorbeeld van oxidatie. Wanneer ijzer in contact komt met zuurstof en vocht, verliezen de ijzeratomen elektronen aan zuurstof, waardoor ijzeroxide (roest) ontstaat en energie vrijkomt.
3. Ademhaling:Zuurstof speelt een fundamentele rol bij de cellulaire ademhaling, een cruciaal proces dat energie genereert in cellen. In zowel planten als dieren wordt zuurstof gebruikt om glucose en andere organische moleculen af te breken om ATP (adenosinetrifosfaat) te produceren, de universele energievaluta van cellen.
4. Biologische reacties:Zuurstof is betrokken bij talrijke biochemische reacties en metabolische processen in levende organismen. Het is bijvoorbeeld van vitaal belang voor de afbraak van koolhydraten, vetten en eiwitten tijdens de spijsvertering, en levert energie en essentiële voedingsstoffen voor groei en onderhoud.
5. Vorming van oxiden:Zuurstof vormt verschillende soorten oxiden wanneer het reageert met andere elementen. Deze oxiden kunnen basisch zijn (bijvoorbeeld natriumoxide, Na2O), zuur (bijvoorbeeld zwaveltrioxide, SO3) of neutraal (bijvoorbeeld koolmonoxide, CO).
6. Reactie met metalen:Zuurstof reageert met veel metalen om metaaloxiden te vormen. Sommige van deze reacties vinden plaats bij kamertemperatuur (bijvoorbeeld oxidatie van natrium tot natriumoxide, Na2O), terwijl andere hogere temperaturen vereisen (bijvoorbeeld oxidatie van ijzer tot ijzeroxide, Fe2O3).
7. Reacties met niet-metalen:Zuurstof reageert ook met niet-metaalhoudende elementen om oxiden of andere verbindingen te vormen. Voorbeelden hiervan zijn de reactie van zuurstof met koolstof om kooldioxide (CO2) te vormen, met waterstof om water (H2O) te vormen en met zwavel om zwaveldioxide (SO2) te vormen.
Over het geheel genomen zorgt de hoge reactiviteit van zuurstof ervoor dat het kan deelnemen aan diverse chemische reacties die cruciaal zijn voor verbranding, ademhaling, biologische processen, industriële toepassingen en de vorming van een breed scala aan verbindingen.
 Baanbrekende kwantumchemietechniek voor computationeel ontwerp en optimalisatie van organische fotofunctionele materialen
Baanbrekende kwantumchemietechniek voor computationeel ontwerp en optimalisatie van organische fotofunctionele materialen Is lithiumhydride een covalente binding?
Is lithiumhydride een covalente binding?  Hoe verkrijgen wetenschappers fluor?
Hoe verkrijgen wetenschappers fluor?  Soja-microbeads zijn een milieuvriendelijk alternatief voor plastic microbeads die worden gebruikt in cosmetica, zeep producten
Soja-microbeads zijn een milieuvriendelijk alternatief voor plastic microbeads die worden gebruikt in cosmetica, zeep producten Ontworpen eiwitschakelaar zorgt voor ongekende controle over levende cellen
Ontworpen eiwitschakelaar zorgt voor ongekende controle over levende cellen
 Extreem weer zou ons misschien kunnen aanmoedigen om samen te werken aan de opwarming van de aarde
Extreem weer zou ons misschien kunnen aanmoedigen om samen te werken aan de opwarming van de aarde NASA volgt een zwakkere tyfoon Wutip door noordwestelijke Stille Oceaan
NASA volgt een zwakkere tyfoon Wutip door noordwestelijke Stille Oceaan Vijf verschillende soorten weerkaarten
Vijf verschillende soorten weerkaarten Van verstrikking tot invasies van uitheemse soorten - de schade veroorzaakt door zwerfvuil op zee
Van verstrikking tot invasies van uitheemse soorten - de schade veroorzaakt door zwerfvuil op zee UITLEG:Waarom huisbescherming belangrijk is bij bosbranden
UITLEG:Waarom huisbescherming belangrijk is bij bosbranden
Hoofdlijnen
- "3-D Printing Goes Cellular
- Wat maakt urine geel? Wetenschappers ontdekken het verantwoordelijke enzym
- Modelleren hoe cellen hun lot kiezen
- Flashmob in de kern:studie maakt duidelijk waarom sommige eiwitten 'samenkomen'
- Veranderingen in de varkenshouderij in de 20e eeuw verspreidden antibioticaresistente Salmonella over de hele wereld, zo blijkt uit onderzoek
- Plastics, ziekteverwekkers en babyvoeding:wat zit er in uw schelpdieren?
- Studie vindt minder vogeldiversiteit in stadsbossen
- De afnemende populaties van koninginnenschelpen zijn gefragmenteerd en dat verandert het natuurbeschermingsspel
- Waarom zwarte neushoorns in gevangenschap ziek kunnen worden
- Eenvoudige arseensensor kan levens redden
- Anionen en kationen in dual-ionbatterijen werken als koeherders- en weversmeisjes

- Wetenschappers ontwikkelen real-time techniek voor het bestuderen van ionische vloeistoffen op elektrode-interfaces
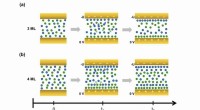
- Technologie gebruikt afval van plantaardige biomassa voor zelfaangedreven biomedische apparaten

- Video:Werken anti-rimpelcrèmes?

 Met NASA-telescoop aan boord, zoeken naar intelligente buitenaardse wezens die geloofwaardiger zijn
Met NASA-telescoop aan boord, zoeken naar intelligente buitenaardse wezens die geloofwaardiger zijn Wat is een verschil tussen de twee soorten voortplanting?
Wat is een verschil tussen de twee soorten voortplanting?  Oceaan in Jupiters maan Europa zou bewoonbaar kunnen zijn
Oceaan in Jupiters maan Europa zou bewoonbaar kunnen zijn Rovers bouwen die leven kunnen detecteren en DNA op andere werelden kunnen rangschikken
Rovers bouwen die leven kunnen detecteren en DNA op andere werelden kunnen rangschikken Italiaanse astronomen inspecteren sterrenstelsel Markarian 509 met ALMA
Italiaanse astronomen inspecteren sterrenstelsel Markarian 509 met ALMA Wat is het belang van microbiologie in de computer?
Wat is het belang van microbiologie in de computer?  Wat veroorzaakt de wolken van een orkaan tot spiraal?
Wat veroorzaakt de wolken van een orkaan tot spiraal?  Rekenpuzzel gaat viraal
Rekenpuzzel gaat viraal
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

