
Wetenschap
Waarom is gasvormige stikstof minder reactief dan fluor?
1. Drievoudige bindingssterkte: Stikstofatomen in N2-moleculen worden bij elkaar gehouden door een sterke drievoudige binding, een van de sterkste chemische bindingen. De bindingsdissociatie-energie van N-N-binding in N2 is ongeveer 946 kJ/mol, wat veel hoger is vergeleken met de bindingsdissociatie-energie van F-F-binding in F2 (159 kJ/mol). Deze sterke drievoudige binding maakt stikstof minder reactief ten opzichte van veel chemische reacties.
2. Hoge elektronegativiteit van fluor: Fluor is het meest elektronegatieve element in het periodiek systeem, wat betekent dat het een sterke neiging heeft om elektronen aan te trekken. Door deze hoge elektronegativiteit kan fluor gemakkelijk bindingen vormen met andere elementen, waaronder stikstof. Stikstof heeft daarentegen een lagere elektronegativiteit, waardoor het minder waarschijnlijk is dat het deelneemt aan bindingsvorming met andere elementen.
3. Inert paareffect: In het geval van stikstof zijn de buitenste elektronen (2p-elektronen) gepaard en relatief stabiel. Dit fenomeen staat bekend als het inerte paareffect. Door dit effect zijn de buitenste elektronen in stikstof minder beschikbaar voor binding met andere atomen, waardoor deze minder reactief is. Fluor daarentegen vertoont geen significant inert paareffect en de buitenste elektronen zijn beter toegankelijk voor bindingsvorming.
4. Afwezigheid van d-orbitalen: Stikstofatomen hebben geen d-orbitalen in hun valentieschil, wat hun vermogen om deel te nemen aan bepaalde soorten chemische reacties beperkt. d Orbitalen zijn essentieel voor veel belangrijke bindingsinteracties, zoals coördinatiecomplexen en pi-backbonding. Fluor daarentegen behoort tot Groep 17 en heeft een complete reeks valentie-orbitalen, inclusief d-orbitalen, waardoor het een breder scala aan chemische reacties kan aangaan.
5. Moleculaire grootte: Stikstofmoleculen (N2) zijn relatief klein en compact vergeleken met fluormoleculen (F2). De compacte structuur van N2 maakt het minder toegankelijk voor andere moleculen of atomen om mee te reageren, waardoor de algehele reactiviteit ervan afneemt. Fluormoleculen zijn kleiner van formaat, hebben een groter oppervlak en zijn beter toegankelijk voor interacties met andere stoffen, wat leidt tot een hogere reactiviteit.
Samenvattend draagt de combinatie van een sterke drievoudige binding, hoge elektronegativiteit van fluor, inert paareffect, afwezigheid van d-orbitalen en verschillen in moleculaire grootte bij aan de lagere reactiviteit van gasvormige stikstof vergeleken met fluor.
 Nieuwe strategie om een in de handel verkrijgbare iboga-alkaloïde om te zetten in post-iboga-alkaloïden
Nieuwe strategie om een in de handel verkrijgbare iboga-alkaloïde om te zetten in post-iboga-alkaloïden Techniek kan het gemakkelijker maken om mRNA te gebruiken om ziekten te behandelen of vaccins af te leveren
Techniek kan het gemakkelijker maken om mRNA te gebruiken om ziekten te behandelen of vaccins af te leveren Dodelijke medicijnen? Wetenschappers werpen licht op het duistere geheim van de flacon van koningin Hatsjepsoet
Dodelijke medicijnen? Wetenschappers werpen licht op het duistere geheim van de flacon van koningin Hatsjepsoet  Wat moet worden gezuiverd door koken en condenseren?
Wat moet worden gezuiverd door koken en condenseren?  Wat is de grondtoestand-elektronenconfiguratie van element Lanthaan?
Wat is de grondtoestand-elektronenconfiguratie van element Lanthaan?
 Klimaatverandering brengt gezondheidszorg in gevaar, meldt rapport
Klimaatverandering brengt gezondheidszorg in gevaar, meldt rapport Blootstelling aan dodelijke stedelijke hitte is de afgelopen decennia wereldwijd verdrievoudigd, zegt studie
Blootstelling aan dodelijke stedelijke hitte is de afgelopen decennia wereldwijd verdrievoudigd, zegt studie Nieuw onderzoek probeert te begrijpen hoe goed Britse tuinen zijn voor bestuivers
Nieuw onderzoek probeert te begrijpen hoe goed Britse tuinen zijn voor bestuivers  Microplastics in overvloed in afgelegen poolzeeën
Microplastics in overvloed in afgelegen poolzeeën Hoe wilde paddestoelen te identificeren in Tennessee
Hoe wilde paddestoelen te identificeren in Tennessee
Hoofdlijnen
- Hoe kan het gras op de greens op een golfbaan zo perfect zijn?
- Roofzuchtige bacteriën gevonden in studie van longmicrobioom van patiënten met cystische fibrose
- Nieuwe inzichten in hoe genen verkering en agressie beheersen
- Voordelen en nadelen van XRD en XRF
- Wat is de complementaire basispaarregel?
- Wat is late telofase?
- Wat zal GLAST ons vertellen?
- Experiment laat zien hoe wormgastheren en het bijbehorende microbioom gezamenlijk bijdragen aan aanpassing aan het milieu
- Kombucha:Wat het is, waar komt het vandaan
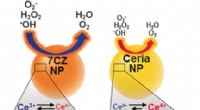
- Ceria-zirconia-nanodeeltjes als verbeterde multi-antioxidanten zijn effectief bij de behandeling van sepsis
- Door slib aangedreven bacteriën wekken meer elektriciteit op, sneller

- Een kwestie van mobiliteit:multidisciplinair artikel suggereert nieuwe strategie voor medicijnontdekking
- Hoe enzymen waterstof produceren

- Vooruitgang in op cellulose gebaseerd voedselverpakkingsmateriaal gaat naar de testfase van industriële productie

 Hoe duwt lift een vleugel omhoog?
Hoe duwt lift een vleugel omhoog?  Hoe werkgevers sociale mobiliteit kunnen stimuleren door de manier waarop ze rekruteren te veranderen
Hoe werkgevers sociale mobiliteit kunnen stimuleren door de manier waarop ze rekruteren te veranderen Maakt lachen jou gelukkig?
Maakt lachen jou gelukkig?  LLNL geeft technologie voor koolstofnanobuisjes in licentie aan lokaal bedrijf
LLNL geeft technologie voor koolstofnanobuisjes in licentie aan lokaal bedrijf Onderzoekers schetsen strategieën voor universiteitspresidenten om een campus door noodsituaties te leiden
Onderzoekers schetsen strategieën voor universiteitspresidenten om een campus door noodsituaties te leiden Soorten spiegels en lenzen
Soorten spiegels en lenzen Hoe schoolsystemen criminelen van zwarte jongeren maken
Hoe schoolsystemen criminelen van zwarte jongeren maken De meeste Amerikanen realiseren zich niet wat bedrijven kunnen voorspellen op basis van hun gegevens
De meeste Amerikanen realiseren zich niet wat bedrijven kunnen voorspellen op basis van hun gegevens
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

