Wetenschap
Een kwestie van mobiliteit:multidisciplinair artikel suggereert nieuwe strategie voor medicijnontdekking
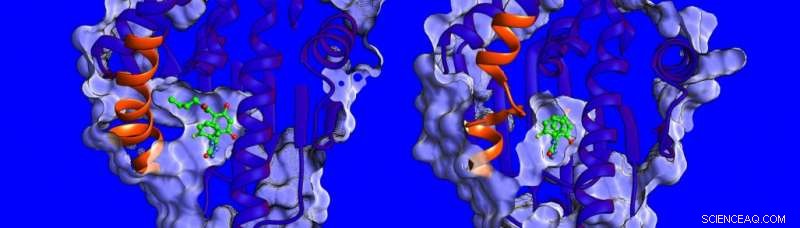
Verschillen in de structuur en dynamiek van het spiraalvormige gebied (getoond in oranje) van het HSP90-eiwit. Krediet:Heidelberg Instituut voor Theoretische Studies
Een gezamenlijke studie van de industrie en de academische wereld van een kankerdoelwiteiwit onthult een ongebruikelijke relatie tussen de flexibiliteit van de bindingsplaats en de levensduur van het geneesmiddel. De resultaten, gepubliceerd in Natuurcommunicatie , suggereren een nieuwe strategie voor het ontdekken van geneesmiddelen. Het onderzoek werd gedaan in het kader van het Kinetics for Drug Discovery K4DD-consortium, ondersteund door het Innovative Medicines Initiative.
De meeste geneesmiddelen oefenen hun therapeutisch effect uit door te binden aan een doeleiwitmolecuul, waardoor de normale functie van het eiwit wordt verstoord. traditioneel, men heeft overwogen dat hoe strakker een geneesmiddel zijn doeleiwit bindt, d.w.z. hoe groter de bindingsaffiniteit is, hoe effectiever het zal zijn. Echter, drugs moeten functioneren in de voortdurend veranderende omgeving van levende organismen. Daarom wordt steeds meer erkend dat niet alleen bindingsaffiniteit en thermodynamica, maar ook de verblijftijden en kinetiek van het medicijn moeten worden geoptimaliseerd tijdens het proces van medicijnontdekking.
Kinetiek op de proef gesteld:een kankerdoelwit bestuderen
Een multidisciplinair team van wetenschappers van K4DD-partners Merck KGaA (Darmstadt), Heidelberg Instituut voor Theoretische Studies (HITS), en het Instituto de Biologia Experimental e Tecnológica (iBET) (Lissabon), toegepaste state-of-the-art experimentele en computationele benaderingen om de determinanten van doelverblijftijden voor een reeks remmers van een veel bestudeerd kankerdoelwit te onderzoeken, hitteschokproteïne 90 (HSP90). HSP90-remmers kunnen de celcyclus verstoren en mogelijk de tumorgroei stoppen. Het team publiceerde onlangs enkele van hun resultaten in: Natuurcommunicatie .
Verrassende resultaten:grotere mobiliteit van bindingsplaatsen leidt tot langere verblijftijden
"Momenteel, er is weinig bekend over de factoren die de verblijftijd van het geneesmiddel beïnvloeden, dus hebben we besloten om de bindende thermodynamica en kinetiek te meten, de structuren van HSP90-remmercomplexen oplossen en hun dynamiek simuleren, " zegt dr. Marta Amaral, een van de corresponderende auteurs. De structuren bepaald door röntgenkristallografie laten zien dat de bindingsholte van HSP90 wordt bekleed door een gebied dat de vorm van een helix of een lus kan aannemen wanneer het aan verschillende remmers wordt gebonden (zie afbeelding hieronder).
De onderzoekers ontdekten dat verbindingen die binden met een aanwezige helix langer binden. "We waren echt verrast, " zegt prof. Rebecca Wade (HITS), "toen we ontdekten dat een belangrijke bijdrage aan de lange verblijftijden de grotere mobiliteit van het spiraalvormige gebied van de bindingszak was toen de remmer bond." Dit ongebruikelijke bindingsmechanisme opent een nieuwe weg voor medicijnontwerp:wetenschappers kunnen minder rigide eiwitdoelen overwegen en moleculen identificeren die meer mobiele vormen van het eiwit stabiliseren bij binding - ongeveer zoals een skischoen met een aanpasbare binnenvoering die zich voortdurend aan de voet aanpast. De bevindingen van deze studie suggereren een nieuwe manier om effectievere kandidaat-geneesmiddelen te vinden met optimale kinetische en thermodynamische eigenschappen.
 Tethered chem combo's kunnen een revolutie teweegbrengen in kunstmatige fotosynthese
Tethered chem combo's kunnen een revolutie teweegbrengen in kunstmatige fotosynthese Chemische makers verzetten zich tegen nieuwe tarieven
Chemische makers verzetten zich tegen nieuwe tarieven Wasbaar elektronisch textiel om een tijdperk van nog slimmere draagbare producten in te luiden
Wasbaar elektronisch textiel om een tijdperk van nog slimmere draagbare producten in te luiden Voor schonere lucht, water, en aarde
Voor schonere lucht, water, en aarde Bio-ingenieurs zetten stap in de richting van een patch die een gebroken hart kan herstellen
Bio-ingenieurs zetten stap in de richting van een patch die een gebroken hart kan herstellen
 Nieuw model kan helpen bij het voorspellen van grote aardbevingen
Nieuw model kan helpen bij het voorspellen van grote aardbevingen Wetenschappers ontdekken hydrothermale ventilatieopeningen op diepe oceaanreis
Wetenschappers ontdekken hydrothermale ventilatieopeningen op diepe oceaanreis Luchtvervuiling in de VS neemt af tijdens de COVID-19-pandemie
Luchtvervuiling in de VS neemt af tijdens de COVID-19-pandemie Onderzoekers brengen het illegale gebruik van natuurlijke hulpbronnen in het beschermde Braziliaanse Amazonegebied in kaart
Onderzoekers brengen het illegale gebruik van natuurlijke hulpbronnen in het beschermde Braziliaanse Amazonegebied in kaart Helpen additieven de bodem?
Helpen additieven de bodem?
Hoofdlijnen
- Gebruik van microscopen in de wetenschap
- Californische vogels nestelen een week eerder dan een eeuw geleden
- Komt mitose voor in Prokaryoten, Eukaryoten of Beide?
- Waar vindt transcriptie plaats in een eukaryote cel?
- Hoe gedraag je je in een dierentuin - volgens de wetenschap
- Alles in de familie:gerichte genomische vergelijkingen
- Wat beïnvloedt een Trait Expression de meeste, genetica of de omgeving?
- Waarom we trekdieren niet te snel de schuld moeten geven van wereldwijde ziekten
- Conserveringsonderzoek gebruikt kleine loopbanden om het uithoudingsvermogen van de zeeschildpadden te testen
 Je hoeft geen raket te bouwen om te bewijzen dat de aarde niet plat is - hier is de simpele wetenschap
Je hoeft geen raket te bouwen om te bewijzen dat de aarde niet plat is - hier is de simpele wetenschap Cryovulkanisme op dwergplaneet Ceres
Cryovulkanisme op dwergplaneet Ceres Hoe robotlegers werken
Hoe robotlegers werken  Kondo-fysica in antiferromagnetische Weyl-halfmetaalfilms
Kondo-fysica in antiferromagnetische Weyl-halfmetaalfilms Wetenschappers gaan de lucht in om de uitstoot van heidebranden in Yorkshire te meten
Wetenschappers gaan de lucht in om de uitstoot van heidebranden in Yorkshire te meten Studie onthult hoe de aardgasproductie in schalie kan worden verbeterd
Studie onthult hoe de aardgasproductie in schalie kan worden verbeterd Een verhoogde focus op voedselzekerheid en duurzaamheid
Een verhoogde focus op voedselzekerheid en duurzaamheid Wetenschappers synthetiseren licht met nieuwe intrinsieke chiraliteit om spiegelmoleculen van elkaar te onderscheiden
Wetenschappers synthetiseren licht met nieuwe intrinsieke chiraliteit om spiegelmoleculen van elkaar te onderscheiden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com