
Wetenschap
Waarom hebben atomen de neiging andere atomen te binden?
1) Stabiliteit . Atomen zijn stabieler als ze gebonden zijn aan andere atomen. Dit komt omdat wanneer atomen gebonden zijn, ze elektronen delen, waardoor een stabielere elektronenconfiguratie ontstaat. Een waterstofatoom heeft bijvoorbeeld één elektron, waardoor het zeer reactief is. Wanneer waterstofatomen zich echter verbinden om waterstofgas (H2) te vormen, deelt elk atoom zijn elektron met het andere atoom, waardoor een stabieler molecuul ontstaat.
2) Energie . Wanneer atomen zich binden, komt er energie vrij. Deze energie kan worden gebruikt om werk te doen, zoals het verplaatsen van objecten of het opwekken van elektriciteit. Wanneer waterstof- en zuurstofatomen zich bijvoorbeeld binden om water te vormen, geven ze energie vrij in de vorm van warmte en licht. Deze energie kan worden gebruikt om voertuigen aan te drijven, elektriciteit op te wekken en huizen te verwarmen.
3) Reactiviteit . Atomen die reactiever zijn, zullen eerder een binding aangaan met andere atomen. Dit komt omdat reactieve atomen meer energie hebben om in de chemische binding te stoppen. Natrium is bijvoorbeeld een zeer reactief metaal dat zich gemakkelijk bindt met andere elementen, zoals chloor, om verbindingen te vormen zoals natriumchloride (NaCl).
4) Elektronenconfiguratie . De elektronenconfiguratie van een atoom bepaalt hoeveel elektronen het kan delen met andere atomen. Atomen met een volledige buitenste elektronenschil zijn bijvoorbeeld zeer stabiel en hebben niet de neiging zich te binden met andere atomen. Het is echter waarschijnlijker dat atomen met een onvolledige buitenste elektronenschil zich binden met andere atomen om hun elektronenschil te voltooien.
5) Grootte . De grootte van een atoom kan ook de neiging ervan beïnvloeden om zich met andere atomen te binden. Kleinere atomen hebben een hogere elektronendichtheid dan grotere atomen, waardoor de kans groter is dat ze zich met andere atomen binden. Koolstof is bijvoorbeeld een klein atoom dat zich gemakkelijk kan binden met andere atomen, zoals waterstof, zuurstof en stikstof, om een grote verscheidenheid aan verbindingen te vormen.
 Potentieel voor natuurlijke hergroei van bossen om koolstof vast te leggen
Potentieel voor natuurlijke hergroei van bossen om koolstof vast te leggen Vrees voor stroomvoorziening terwijl troepen opgeroepen worden om de bosbranden in Australië te bestrijden (update)
Vrees voor stroomvoorziening terwijl troepen opgeroepen worden om de bosbranden in Australië te bestrijden (update) Globale oceanische dode zones bleven 50 jaar bestaan, 000 jaar na het uitsterven van het einde van het Trias
Globale oceanische dode zones bleven 50 jaar bestaan, 000 jaar na het uitsterven van het einde van het Trias Het fenomeen van snelle wolkenopruiming kan een nieuw stukje klimaatpuzzel opleveren
Het fenomeen van snelle wolkenopruiming kan een nieuw stukje klimaatpuzzel opleveren Stof uit de Sahara verstikt Zwitserland en Zuidoost-Frankrijk
Stof uit de Sahara verstikt Zwitserland en Zuidoost-Frankrijk
Hoofdlijnen
- Hoe hunkering naar voedsel
- Hé voorstedelijke mensen, ontmoet de buren:tekendragende witstaarthert
- Zullen geavanceerde organismen hetzelfde zijn als complexe organismen, waarom?
- Verschillen langlevende gewassen van jaarlijkse gewassen in hun genetische reactie op menselijke domesticatie?
- Een kungfu-kick leidde onderzoekers naar 's werelds oudste complete visfossielen. Dit is wat ze hebben gevonden
- Nieuwe studie suggereert dat de laatste gemeenschappelijke voorouder van mensen en apen kleiner was dan gedacht
- De 3D-structuur van het genoom bepaalt hoe genen tot expressie worden gebracht
- Wat zijn drie primaire doelen van mitose?
- Een verklaring van het skeletsysteem
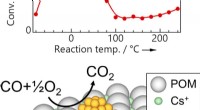
- Ultra-efficiënte verwijdering van koolmonoxide met behulp van gouden nanodeeltjes op een moleculaire drager
- Hou je van een drankje? Japans team vindt houtalcohol uit

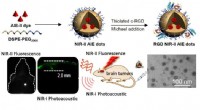
- Nieuwe methode helpt orthotope beeldvorming van hersentumoren duidelijker en sneller te maken
- Diagnostische vooruitgang:gasgevoelige capsule komt in 2022 op de markt

- Op de natuur geïnspireerde kristalstructuurvoorspeller
 Op de hoogte blijven van de Wet van Moore
Op de hoogte blijven van de Wet van Moore Een onderzoek naar huizenprijzen:wegen de openbaarmaking van de voordelen op tegen de risico's?
Een onderzoek naar huizenprijzen:wegen de openbaarmaking van de voordelen op tegen de risico's?  Wat is verzuring van de oceaan, en waarom doet het ertoe?
Wat is verzuring van de oceaan, en waarom doet het ertoe?  Onderzoekers draaien de klok terug om de leeftijd en de plaats van de supernova-explosie te berekenen
Onderzoekers draaien de klok terug om de leeftijd en de plaats van de supernova-explosie te berekenen Russische waakhond start administratieve procedure tegen Facebook, Twitter
Russische waakhond start administratieve procedure tegen Facebook, Twitter Waarom transporteurs echt belangrijk zijn voor celfabrieken
Waarom transporteurs echt belangrijk zijn voor celfabrieken  De afgifte van FZD4 door nanodeeltjes aan longendotheelcellen remt de progressie van longkanker en metastasen
De afgifte van FZD4 door nanodeeltjes aan longendotheelcellen remt de progressie van longkanker en metastasen  Er zijn aanwijzingen gevonden over hoe de bodem kan reageren op klimaatverandering
Er zijn aanwijzingen gevonden over hoe de bodem kan reageren op klimaatverandering
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

