
Wetenschap
Wat maakt een oplosmiddel polair?
Een oplosmiddel wordt als polair beschouwd als het een netto positieve of negatieve lading heeft of als het functionele groepen met significante dipoolmomenten bevat. Verschillende factoren dragen bij aan de polariteit van een oplosmiddel:
1. Elektronegativiteitsverschillen:De elektronegativiteit van atomen in het oplosmiddelmolecuul kan polaire bindingen creëren. Elektronegativiteit is het vermogen van een atoom om elektronen naar zichzelf toe te trekken. Wanneer atomen met verschillende elektronegativiteiten gebonden zijn, worden de elektronen ongelijk verdeeld, wat resulteert in een gedeeltelijk positieve lading op het ene atoom en een gedeeltelijk negatieve lading op het andere. Dit verschil in elektronegativiteit creëert een dipoolmoment.
2. Dipoolmomenten:Dipoolmomenten zijn vectoren die de grootte en richting van de ladingsscheiding in een molecuul vertegenwoordigen. De algehele polariteit van een oplosmiddel hangt af van het netto dipoolmoment van de samenstellende moleculen. Oplosmiddelen met hoge netto dipoolmomenten zijn polairder dan die met lage of nul dipoolmomenten.
3. Waterstofbinding:Waterstofbinding is een sterke dipool-dipoolinteractie die optreedt tussen een waterstofatoom dat covalent gebonden is aan een elektronegatief atoom (zoals N, O of F) en een ander elektronegatief atoom. Waterstofbinding kan de polariteit van een oplosmiddel aanzienlijk verbeteren door de intermoleculaire krachten tussen de moleculen te versterken.
4. Diëlektrische constante:De diëlektrische constante (ε) van een oplosmiddel is een maatstaf voor zijn vermogen om de elektrostatische kracht tussen geladen deeltjes te verminderen. Polaire oplosmiddelen hebben over het algemeen hogere diëlektrische constanten dan niet-polaire oplosmiddelen. Een hoge diëlektrische constante geeft aan dat het oplosmiddel effectief ionen of andere geladen soorten kan oplossen door de sterkte van elektrostatische interacties te verminderen.
Voorbeelden van polaire oplosmiddelen zijn water, alcoholen (zoals methanol, ethanol en isopropanol), dimethylformamide (DMF) en aceton. Deze oplosmiddelen hebben elektronegatieve atomen (O, N of F) die polaire bindingen creëren en kunnen deelnemen aan waterstofbindingen. Aan de andere kant hebben niet-polaire oplosmiddelen zoals hexaan, benzeen en tolueen lage diëlektrische constanten en bevatten ze geen significante dipoolmomenten of waterstofbindingsmogelijkheden.
Samenvattend wordt de polariteit van een oplosmiddel bepaald door de aanwezigheid van elektronegatieve atomen, dipoolmomenten en waterstofbindingsmogelijkheden binnen zijn moleculen. Polaire oplosmiddelen hebben een netto positieve of negatieve lading of bevatten functionele groepen met aanzienlijke dipoolmomenten, wat hun solvaterende eigenschappen en interacties met andere moleculen beïnvloedt.
 Het is de hoogste tijd voor het plan van Californië om plastic voor eenmalig gebruik tegen 2030 uit te faseren
Het is de hoogste tijd voor het plan van Californië om plastic voor eenmalig gebruik tegen 2030 uit te faseren Oceaanplanten in de zonzone
Oceaanplanten in de zonzone  De droge juni van Australië is een teken van wat komen gaat
De droge juni van Australië is een teken van wat komen gaat Aarde recycleert oceaanbodem tot diamanten
Aarde recycleert oceaanbodem tot diamanten Natuurmysterie:waarom zwemmen grijze walvissen in steeds grotere aantallen de Baai van San Francisco binnen?
Natuurmysterie:waarom zwemmen grijze walvissen in steeds grotere aantallen de Baai van San Francisco binnen?
Hoofdlijnen
- Studie onderzoekt de effecten van insecticiden op honingbijen
- Onderzoek onderzoekt waarom mensen eerder van etniciteit veranderen
- Waarom genoombewerking een gerichte manier biedt om betere gewassen te veredelen
- Soorten bacteriën in levensmiddelen
- Wetenschappers vinden antarctische microben die alleen van lucht leven
- Wetenschappers onthullen hoe een weinig bekende amoebe een bacterie overspoelde om fotosynthetisch te worden
- Onderzoek laat zien hoe slijm microben temt
- Onderzoek laat zien hoe cellen grote genen verwerken
- Pythons zijn echte verstikkende artiesten:grootte alleen verklaart niet hoe ze zulke grote prooien kunnen eten
- Chemie zorgt voor een nieuwe voorraad van een veelbelovende kanker- en hiv-behandeling

- Een nieuw pad voor duurzame opconversie van fotonen met niet-edele metalen
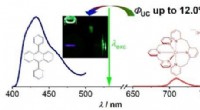
- Studie van olifant, capibara, mensenhaar vindt dat dikker haar niet altijd sterker is

- Doorbraak in onderzoek naar schone diesel

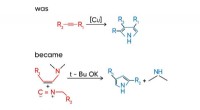
- Chemici stellen een nieuwe methode voor voor de synthese van pyrrolen
 Onderzoekers hebben mogelijk het defect aan de spiegeltweeling opgelost dat de volgende generatie 2D-halfgeleiders teistert
Onderzoekers hebben mogelijk het defect aan de spiegeltweeling opgelost dat de volgende generatie 2D-halfgeleiders teistert  Nieuw, snel mechanisme voor de vorming van atmosferische deeltjes
Nieuw, snel mechanisme voor de vorming van atmosferische deeltjes Zijn de reacties van gewone moleculaire waterstof langzaam of snel?
Zijn de reacties van gewone moleculaire waterstof langzaam of snel?  Miljoenen bomen meer is niet de klimaatoplossing die Nieuw-Zeeland dacht
Miljoenen bomen meer is niet de klimaatoplossing die Nieuw-Zeeland dacht  Allemaal aan boord van de neutronentrein - restspanningen in kaart brengen voor robuustere rails
Allemaal aan boord van de neutronentrein - restspanningen in kaart brengen voor robuustere rails Onderzoekers vinden nieuwe manieren om afbeeldingen, kenmerken uniek materiaal
Onderzoekers vinden nieuwe manieren om afbeeldingen, kenmerken uniek materiaal Dyson op weg naar elektrische auto voor elk terrein
Dyson op weg naar elektrische auto voor elk terrein Feiten over bekkens
Feiten over bekkens
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

