
Wetenschap
Welk molecuul heeft een dipoolmoment H2 CO2 F2 SO2 BF3?
Van de gegeven moleculen zijn CO2 en BF3 niet-polaire moleculen, wat betekent dat ze geen dipoolmoment hebben. Dit komt omdat de elektronegativiteit van koolstof- en zuurstofatomen in CO2 vrijwel hetzelfde is, wat resulteert in een symmetrische verdeling van elektronen rond het molecuul. Op dezelfde manier is de elektronegativiteit van boor- en fluoratomen in BF3 vrijwel hetzelfde, wat leidt tot een symmetrische elektronenverdeling.
H2, F2 en SO2 zijn polaire moleculen en hebben dipoolmomenten. In H2 is de elektronegativiteit van waterstofatomen iets anders, waardoor er een lichte onbalans in de elektronenverdeling ontstaat, wat resulteert in een dipoolmoment. In F2 zorgt de elektronegativiteit van fluoratomen voor een significant verschil in de elektronenverdeling, wat resulteert in een aanzienlijk dipoolmoment. In SO2 leidt de elektronegativiteit van zuurstof- en zwavelatomen tot een vervormde elektronenwolk, waardoor een dipoolmoment ontstaat.
Daarom zijn de moleculen met een dipoolmoment:H2, F2 en SO2.
 Theoretische opbrengst berekenen in Moles & Grams
Theoretische opbrengst berekenen in Moles & Grams Hoe hebben zuren en basen invloed op ons dagelijks leven?
Hoe hebben zuren en basen invloed op ons dagelijks leven?  Welke kleur heeft pH-papier met bleekmiddel?
Welke kleur heeft pH-papier met bleekmiddel?  Onderzoekers ontwikkelen lab-on-a-chip voor gepersonaliseerde monitoring van de werkzaamheid van geneesmiddelen
Onderzoekers ontwikkelen lab-on-a-chip voor gepersonaliseerde monitoring van de werkzaamheid van geneesmiddelen Nieuwe tool monitort realtime mutaties bij griep
Nieuwe tool monitort realtime mutaties bij griep
 De klok tikt op netto-nul, en Australische boeren mogen geen gratis pas krijgen
De klok tikt op netto-nul, en Australische boeren mogen geen gratis pas krijgen Een nieuwe thermometer om ons klimaat in het verleden te bestuderen
Een nieuwe thermometer om ons klimaat in het verleden te bestuderen Wie neemt de uiteindelijke beslissing? AI-gestuurd rampenbeheer
Wie neemt de uiteindelijke beslissing? AI-gestuurd rampenbeheer Insecten en insecten die op Vlooien lijken
Insecten en insecten die op Vlooien lijken  Onderwater oud cipressenbos biedt aanwijzingen voor het verleden
Onderwater oud cipressenbos biedt aanwijzingen voor het verleden
Hoofdlijnen
- Hoe wisten dinosaurusouders dat hun kinderen koorts hadden?
- Vos-eekhoorns tonen inzicht in langetermijninvesteringen bij het hamsteren van noten
- Wat zijn de kenmerken die alle bacteriën gemeenschappelijk hebben?
- Van wortels tot veerkracht:onderzoek naar de vitale rol van microben in de gezondheid van kustplanten
- Wat is een gras? Chloroplast-DNA laat zien dat gras dat misschien niet is
- Duurzame biotechnologie werkelijkheid maken:Gebundelde krachten willen biokatalysatoren verbeteren
- Ondiepwaterwinning is geen duurzaam alternatief voor diepwaterwinning, beweren wetenschappers
- Muggen gebruiken darmbacteriën om de malaria die ze overbrengen te bestrijden. Wetenschappers onderzoeken hoe dit komt
- Human Heart Science Projects
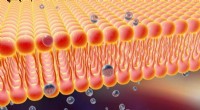
- Fluorescerende sondes bewijzen het bestaan van celmembraanstructuren van lipidenvlotten
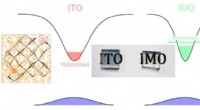
- Wetenschappers ontwerpen ontdekking verdubbelt geleidbaarheid van indiumoxide transparante coatings
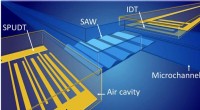
- NIST-ontdekking zou de nauwkeurigheid kunnen vergroten bij het meten van de bloedstroom voor kankerdiagnose, andere toepassingen
- 30 tinten staal:wetenschappers ontwikkelen spiekbriefje voor het maken van nieuwe staalsoorten

- Multimodale beeldvorming toont aan dat spanning de chemie in een fotovoltaïsch materiaal kan stimuleren

 Eclipse 2017:Wetenschap vanuit de schaduw van de manen
Eclipse 2017:Wetenschap vanuit de schaduw van de manen Volg het ... en ze zullen komen
Volg het ... en ze zullen komen Is de hoeveelheid kwik in spaarlampen gevaarlijker dan de hoeveelheid in vis?
Is de hoeveelheid kwik in spaarlampen gevaarlijker dan de hoeveelheid in vis?  Wat is eindgroepanalyse in polymeer?
Wat is eindgroepanalyse in polymeer?  Hoe u uw huis kunt voorbereiden op hittegolven in de zomer
Hoe u uw huis kunt voorbereiden op hittegolven in de zomer  Hoe hete (en niet zo hete) verbindingen in chilipepers veranderen tijdens het rijpen
Hoe hete (en niet zo hete) verbindingen in chilipepers veranderen tijdens het rijpen  3d printen, biologieonderzoek maakt de reis terug naar de aarde aan boord van SpaceXs Dragon
3d printen, biologieonderzoek maakt de reis terug naar de aarde aan boord van SpaceXs Dragon De kracht van randomisatie:magnetische skyrmionen voor nieuwe computertechnologie
De kracht van randomisatie:magnetische skyrmionen voor nieuwe computertechnologie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

