
Wetenschap
Wat gebeurt er als kopersulfaat oplost in water?
CuSO4 → Cu²⁺ + SO4²⁻
Deze reactie suggereert dat de kopersulfaatverbinding dissocieert in de samenstellende ionen wanneer deze in contact komt met water. Cu²⁺ vertegenwoordigt het koperion, dat een positieve lading (2+) heeft vanwege het verlies van twee elektronen, terwijl SO4²⁻ het sulfaation vertegenwoordigt, dat een negatieve lading (2-) heeft omdat het twee elektronen heeft gekregen.
Als gevolg van dit dissociatieproces worden de koperionen (Cu²⁺) en sulfaationen (SO4²⁻) omgeven door watermoleculen en gelijkmatig door de oplossing verspreid. De watermoleculen interageren met de ionen door middel van elektrostatische interacties en vormen een zogenaamde hydratatiesfeer. Er wordt dan gezegd dat de gehydrateerde koperionen en sulfaationen in oplossing zijn, en het resulterende mengsel wordt een kopersulfaatoplossing genoemd.
Het is belangrijk op te merken dat de dissociatie van kopersulfaat in water een dynamisch evenwicht is, wat betekent dat de verbinding zowel kan dissociëren als recombineren om CuSO4-moleculen te vormen. Bij kamertemperatuur blijft het grootste deel van het kopersulfaat echter gedissocieerd in water, wat leidt tot de aanwezigheid van afzonderlijke koperionen en sulfaationen in de oplossing.
Het vermogen van kopersulfaat om in water op te lossen wordt vergemakkelijkt door de polariteit van watermoleculen. Water is een polair oplosmiddel, wat betekent dat het gebieden heeft met gedeeltelijk positieve ladingen en gebieden met gedeeltelijk negatieve ladingen. De gedeeltelijk positieve gebieden van watermoleculen kunnen interageren met de negatieve sulfaationen (SO4²⁻), terwijl de gedeeltelijk negatieve gebieden van watermoleculen kunnen associëren met de positieve koperionen (Cu²⁺). Deze elektrostatische aantrekkingskracht tussen de ionen en watermoleculen bevordert het oplossen van kopersulfaat in water.
 Wat is de PH en geleidbaarheid in DM-water?
Wat is de PH en geleidbaarheid in DM-water?  Welke elementen maken magnesiumsulfaat?
Welke elementen maken magnesiumsulfaat?  Wat is een neutrale groep atomen die bij elkaar worden gehouden door een covalente binding?
Wat is een neutrale groep atomen die bij elkaar worden gehouden door een covalente binding?  Proost! Wetenschappers zetten grote stap in de richting van het perfecte bierhoofd
Proost! Wetenschappers zetten grote stap in de richting van het perfecte bierhoofd Het blootleggen van bacteriële celwandgeheimen om antibioticaresistentie te bestrijden
Het blootleggen van bacteriële celwandgeheimen om antibioticaresistentie te bestrijden
 Pas op voor de geur van bittere amandelen:waarom bevatten veel voedselplanten cyanide?
Pas op voor de geur van bittere amandelen:waarom bevatten veel voedselplanten cyanide?  Kustduinen trekken zich terug naarmate de zeespiegel stijgt. Uit onderzoek blijkt dat de snelheid van de veranderingen steeds sneller gaat
Kustduinen trekken zich terug naarmate de zeespiegel stijgt. Uit onderzoek blijkt dat de snelheid van de veranderingen steeds sneller gaat  bijna 4, 500 Amazon-medewerkers dagen bedrijf uit om het voortouw te nemen in beleid inzake klimaatverandering
bijna 4, 500 Amazon-medewerkers dagen bedrijf uit om het voortouw te nemen in beleid inzake klimaatverandering Kaspische Zee-landen ondertekenen mijlpaalovereenkomst
Kaspische Zee-landen ondertekenen mijlpaalovereenkomst Kooldioxideniveaus bereikten 50% hoger dan pre-industriële tijd
Kooldioxideniveaus bereikten 50% hoger dan pre-industriële tijd
Hoofdlijnen
- 3D-eiwitmodellering suggereert waarom COVID-19 sommige dieren infecteert, maar andere niet
- Waarom is de beker stabiel?
- Naar huis vliegen? IJstijd heeft de vogeltrek mogelijk afgeremd
- Bacteriën Levenscyclus
- Wat reguleert de eiwitproductie in de kern?
- Onderzoek naar plantenenzymen toont aan dat eiwitten hun structurele rangschikking met verrassend gemak kunnen veranderen
- In ons lichaam zijn teams van microben aan het werk. Onderzoekers hebben ontdekt waar ze mee bezig zijn.
- Onderzoek onderzoekt hoe een sleutelgen het terpeenaroma in druiven moduleert
- Epigenetische inzichten:hoe hybride populier scheuten regenereert
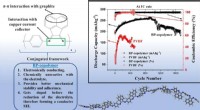
- Nieuw copolymeerbindmiddel om de levensduur van lithium-ionbatterijen te verlengen
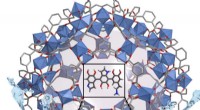
- Zware metalen uit water verwijderen met MOF's
- Een nieuwe eiwit-spin-labelingtechniek
- Drugsgebruiktrends vroeg in de COVID-19-pandemie wegspoelen

- Implanteerbaar piëzo-elektrisch polymeer verbetert gecontroleerde afgifte van medicijnen
 Autonome drones die intelligent kunnen zien en vliegen
Autonome drones die intelligent kunnen zien en vliegen Wie was de eerste koning ter wereld?
Wie was de eerste koning ter wereld?  Waar wordt steenkoolenergie gevonden?
Waar wordt steenkoolenergie gevonden?  Supersymmetrie doorbreken
Supersymmetrie doorbreken Ontbonden EPA-panel voor schone luchtwetenschap vond dat regelgeving voor deeltjesvervuiling niet voldoende is
Ontbonden EPA-panel voor schone luchtwetenschap vond dat regelgeving voor deeltjesvervuiling niet voldoende is Kleine belletjes:astma behandelen met gen-uitschakeling nanocapsules
Kleine belletjes:astma behandelen met gen-uitschakeling nanocapsules Cryptische koraalrifwezens vertonen biodiversiteitspatronen over de hele plank heen
Cryptische koraalrifwezens vertonen biodiversiteitspatronen over de hele plank heen  Wat maakt begraafplaatsen eng?
Wat maakt begraafplaatsen eng?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

