
Wetenschap
Wat is de beperkende reactant in Zn 2HCl -- ZnCl2 H2?
Gegeven de uitgebalanceerde chemische vergelijking:
$$Zn + 2HCl -> ZnCl_2 + H_2$$
Laten we aannemen dat we aanvankelijke aantallen reactanten a voor Zn en b voor HCl hebben.
Voor Zn:
Mol van Zn =a
Voor HCl:
Mol HCl =b
Volgens de stoichiometrie reageert 1 mol Zn met 2 mol HCl. De molverhouding is dus 1:2.
Als a <2b, betekent dit dat er niet genoeg molen HCl zijn om volledig met Zn te reageren. In dit geval is HCl de beperkende reactant.
Als a> 2b, betekent dit dat er een overmaat aan Zn is en dat niet al het Zn zal worden verbruikt. In dit geval is Zn de beperkende reactant.
Om de beperkende reactant te bepalen zonder de werkelijke waarden van a en b te kennen, kunnen we de molverhoudingen vergelijken. Als de verhouding tussen het aantal molen Zn en het aantal molen HCl kleiner is dan 1:2, dan is HCl de beperkende reactant. Als de verhouding groter is dan 1:2, dan is Zn de beperkende reactant.
Om de beperkende reactant in de reactie Zn + 2HCl -> ZnCl2 + H2 te bepalen, moeten we daarom de initiële molaire hoeveelheden Zn en HCl vergelijken en controleren of de molaire verhouding kleiner of groter is dan 1:2.
 Coördinatiepolymeerglas biedt solide ondersteuning voor waterstofbrandstofcellen
Coördinatiepolymeerglas biedt solide ondersteuning voor waterstofbrandstofcellen Nieuw 2D metalen organisch raamwerk met interessante elektrische geleidbaarheid en magnetische eigenschappen
Nieuw 2D metalen organisch raamwerk met interessante elektrische geleidbaarheid en magnetische eigenschappen Het belang van Boyles Gas Law in het dagelijks leven
Het belang van Boyles Gas Law in het dagelijks leven Waarom is de C-CL-bindingslengte korter in vinylchloride dan in ethylchloride?
Waarom is de C-CL-bindingslengte korter in vinylchloride dan in ethylchloride?  Wat is de bindingsstructuur van natrium?
Wat is de bindingsstructuur van natrium?
 Welke richting moet een Bluebird House onder ogen zien?
Welke richting moet een Bluebird House onder ogen zien?  Heeft de mens zichzelf gedomesticeerd?
Heeft de mens zichzelf gedomesticeerd?  Spanje schopt uit sneeuwbanken achtergelaten door storm Filomena
Spanje schopt uit sneeuwbanken achtergelaten door storm Filomena Hoe veranderingen veroorzaakt door het coronavirus de klimaatverandering kunnen helpen aanpakken
Hoe veranderingen veroorzaakt door het coronavirus de klimaatverandering kunnen helpen aanpakken Inheemse stammen van Alaska nemen het voortouw bij het testen van schelpdiertoxines waar de staat tekortschiet
Inheemse stammen van Alaska nemen het voortouw bij het testen van schelpdiertoxines waar de staat tekortschiet
Hoofdlijnen
- Waarom pneumokokken vooral mensen treffen
- Uit de problemen komen:helpt mobiel DNA?
- Waarom zijn mannelijke muizen bang voor bananen?
- Studie werpt licht op hoe cellen materialen transporteren langs drukke intercellulaire 'snelwegen'
- Schippers dumpen afval in de wateren van Zuid-Florida? Tieners worden beschuldigd van misdrijf
- De wetenschap zegt:wat er gebeurt als onderzoekers fouten maken
- In welk bioom werken ontleders het meest efficiënt?
- Een vis, twee vissen - met behulp van een nieuw door MBARI ontworpen camerasysteem om roodbaars te tellen
- Waarom 'democratie door afschrikking' in de Verenigde Staten zou kunnen verzwakken
- Herkomst van levensinzicht:peptiden kunnen zich vormen zonder aminozuren
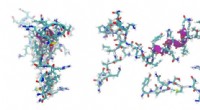
- Wetenschappers verduidelijken aspect van interacties tussen vaste stoffen en vloeistoffen in dunne film

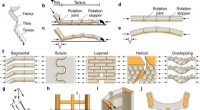
- Nieuwe ontdekking in exoskeletten van dieren leidt tot vooruitgang in het ontwerpen van bouwmaterialen
- Open-sourcesoftware verwerkt snel spectrale gegevens, identificeert en kwantificeert nauwkeurig lipidensoorten

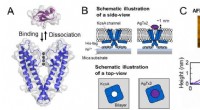
- Mechanisme van remming van schorpioentoxine van K+-kanaal opgehelderd met behulp van snelle AFM
 Voedselketens en hoe ze worden beïnvloed door waterverontreiniging
Voedselketens en hoe ze worden beïnvloed door waterverontreiniging  Google Glass en Apple iWatch inspireren koolstof-nanobuisvezelbatterijen
Google Glass en Apple iWatch inspireren koolstof-nanobuisvezelbatterijen Canada gaat plastic voor eenmalig gebruik, zoals tassen, rietjes tegen eind 2021
Canada gaat plastic voor eenmalig gebruik, zoals tassen, rietjes tegen eind 2021 Gezondheidseffecten van het klimaatbeleid van China strekken zich uit over de Stille Oceaan
Gezondheidseffecten van het klimaatbeleid van China strekken zich uit over de Stille Oceaan DNA-schade begrijpen:modelleren hoe schade aan elektronen met lage energie de bestralingstherapie kan verbeteren
DNA-schade begrijpen:modelleren hoe schade aan elektronen met lage energie de bestralingstherapie kan verbeteren  Afbeelding:missie van het energiedepartement gelanceerd vanuit Wallops
Afbeelding:missie van het energiedepartement gelanceerd vanuit Wallops Het effect van licht op plantengroei
Het effect van licht op plantengroei  Tiny wires een stap richting fotonische chip
Tiny wires een stap richting fotonische chip
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

