
Wetenschap
Is een waterstofbrug een echte binding?
Hier zijn de belangrijkste verschillen tussen een waterstofbrug en een echte chemische binding:
1. Kracht: Waterstofbruggen zijn zwakker dan echte chemische bindingen. Ze hebben bindingsenergieën van ongeveer 5-30 kJ/mol, terwijl typische covalente bindingen bindingsenergieën hebben van honderden kJ/mol.
2. Aard van interactie: Waterstofbindingen omvatten de elektrostatische aantrekking tussen een gedeeltelijk positief waterstofatoom en een gedeeltelijk negatief elektronegatief atoom, terwijl echte chemische bindingen het delen of overbrengen van elektronen met zich meebrengen.
3. Directionaliteit: Waterstofbruggen hebben een zekere mate van directionaliteit, omdat ze de neiging hebben zich te vormen langs specifieke uitlijningen tussen de waterstof- en elektronegatieve atomen. Echte chemische bindingen kunnen daarentegen meer isotroop zijn en hebben niet dezelfde richtingsvoorkeuren.
4. Aantal obligaties: Waterstofbindingen zijn doorgaans beperkt tot één waterstofatoom per elektronegatief atoom, terwijl echte covalente bindingen meerdere elektronenparen tussen atomen kunnen omvatten.
5. Omkeerbaarheid: Waterstofbruggen kunnen gemakkelijk worden verbroken en hervormd, waardoor ze dynamisch van aard zijn. Echte chemische bindingen zijn, eenmaal gevormd, over het algemeen stabieler en vereisen meer energie om te breken.
Samenvattend worden waterstofbruggen niet als echte chemische bindingen beschouwd vanwege hun zwakkere sterkte, intermoleculaire aard, richtingsvoorkeuren en dynamisch gedrag. Het zijn belangrijke niet-covalente interacties die een cruciale rol spelen in veel biologische systemen, moleculaire structuren en chemische processen, en bijdragen aan eigenschappen zoals oplosbaarheid, moleculaire herkenning en eiwitvouwing.
 Softwareprogramma Allchemy identificeert prebiotische synthese van biochemische verbindingen uit oer-precursoren
Softwareprogramma Allchemy identificeert prebiotische synthese van biochemische verbindingen uit oer-precursoren Wat is het verschil tussen een oplosmiddel en verdunningsmiddel?
Wat is het verschil tussen een oplosmiddel en verdunningsmiddel?  Eerste microarrayed 3D-neuronaal cultuurplatform ontwikkeld
Eerste microarrayed 3D-neuronaal cultuurplatform ontwikkeld Ontdekking van een nieuwe wet van fasescheiding
Ontdekking van een nieuwe wet van fasescheiding Onderzoek naar poreuze koolstofvezels een stap dichter bij gebruik in de auto-industrie
Onderzoek naar poreuze koolstofvezels een stap dichter bij gebruik in de auto-industrie
 80 jaar sinds de eerste berekeningen aantoonden dat de aarde opwarmde door de toenemende uitstoot van broeikasgassen
80 jaar sinds de eerste berekeningen aantoonden dat de aarde opwarmde door de toenemende uitstoot van broeikasgassen Hoe krijgen we de stedelijke dichtheid 'precies goed'? De zoektocht van Goudhaartje naar het ‘ontbrekende midden’
Hoe krijgen we de stedelijke dichtheid 'precies goed'? De zoektocht van Goudhaartje naar het ‘ontbrekende midden’  Noah-MP legt belangrijke hydrologische patronen vast in China
Noah-MP legt belangrijke hydrologische patronen vast in China De verschillende soorten landvormen
De verschillende soorten landvormen  3 doden, staatshoofdstad geteisterd terwijl stormen Missouri teisteren
3 doden, staatshoofdstad geteisterd terwijl stormen Missouri teisteren
Hoofdlijnen
- Van stamcellen afgeleide levercellen geven nieuwe aanwijzingen voor ebola
- Biodiversiteit behouden of genetische diversiteit plunderen? Wat doet het fokken in gevangenschap met de vispopulaties?
- Variabel gif:waarom zijn sommige slangen dodelijker dan andere?
- Hoeveel lentestikstof toe te passen? Het weer vóór het planten kan een aanwijzing zijn
- Kan bionisch lezen je sneller laten lezen?
- Van druppel tot ontdekking
- Een pinguïn met een onconventionele roep inspireert onderzoekers om de manier waarop ze pinguïns bestuderen te veranderen
- Wetenschappers ontcijferen het genoom van herfstlegerworm, mottenplaag die Afrika binnendringt
- Hoe elektrische vissen organen konden ontwikkelen
- Wetenschappers bakken glutenvrij brood met een revolutionaire technologie

- Pilaarachtige moleculen als biosensoren voor metabolieten
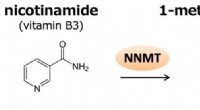
- Team ontdekt door licht aangedreven katalysator vormt olefinen voor medicijn, agrochemische productie

- Eenstapskatalysator zet nitraten om in water en lucht

- Kooimoleculen fungeren als moleculaire zeven voor de scheiding van waterstofisotopen
 Onthulling van de magnetische aard van tornado's in de atmosfeer van de zon
Onthulling van de magnetische aard van tornado's in de atmosfeer van de zon Heterostructuur en Q-factor engineering voor laagdrempelige en persistente nanodraadlasing
Heterostructuur en Q-factor engineering voor laagdrempelige en persistente nanodraadlasing Massa-extinctie waarschijnlijk veroorzaakt door dodelijke temperaturen als gevolg van vulkanische CO2-ontluchting
Massa-extinctie waarschijnlijk veroorzaakt door dodelijke temperaturen als gevolg van vulkanische CO2-ontluchting Hoe militaire robots werken
Hoe militaire robots werken  Aardverschuivingsmodellering na Kaikoura Quake levert gegevens aan eerstehulpverleners
Aardverschuivingsmodellering na Kaikoura Quake levert gegevens aan eerstehulpverleners Wat hebben de herten in het ecosysteem?
Wat hebben de herten in het ecosysteem?  Great Barrier Reef stuitert niet terug zoals voorheen, maar er is hoop
Great Barrier Reef stuitert niet terug zoals voorheen, maar er is hoop Ruimteagentschappen ter wereld stellen voor om klimaatobservatorium op te richten
Ruimteagentschappen ter wereld stellen voor om klimaatobservatorium op te richten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

