
Wetenschap
DNA-schade begrijpen:modelleren hoe schade aan elektronen met lage energie de bestralingstherapie kan verbeteren
Elektronen met lage energie, ook wel subexcitatie-elektronen genoemd, bezitten relatief lage kinetische energieën en kunnen hun energie via verschillende mechanismen in biologische weefsels afzetten. Eén belangrijke route is de excitatie van DNA-basen, wat leidt tot de vorming van voorbijgaande anionische toestanden. Deze anionische toestanden kunnen daaropvolgende reacties ondergaan, resulterend in verschillende soorten DNA-schade, waaronder enkelstrengsbreuken, dubbelstrengsbreuken en basemodificaties.
Het modelleren van door elektronen geïnduceerde DNA-schade met lage energie speelt een cruciale rol bij het begrijpen van de onderliggende mechanismen en het voorspellen van de biologische effecten van bestralingstherapie. Computationele methoden, zoals kwantummechanica en simulaties van moleculaire dynamica, worden gebruikt om de interacties tussen laagenergetische elektronen en DNA-moleculen te simuleren. Deze simulaties bieden gedetailleerd inzicht in de energiedepositieprocessen, de vorming van voorbijgaande anionische toestanden en de dynamiek van de vorming van DNA-schade.
Door het nauwkeurig modelleren van door elektronen geïnduceerde DNA-schade met lage energie kunnen onderzoekers waardevolle kennis opdoen die kan worden gebruikt om de werkzaamheid van bestralingstherapie te verbeteren. Hier zijn een paar specifieke manieren waarop deze kennis kan worden toegepast:
Bestralingsbehandelingsplannen optimaliseren:
Het begrijpen van de aard en omvang van DNA-schade veroorzaakt door elektronen met lage energie maakt nauwkeurigere dosimetrie en behandelingsplanning mogelijk. Door deze kennis op te nemen in behandelingsalgoritmen kunnen artsen de stralingsdoses aanpassen om kankercellen effectiever aan te pakken en tegelijkertijd de schade aan gezonde weefsels te minimaliseren.
Het ontwikkelen van nieuwe radiosensitizers:
Radiosensitizers zijn middelen die de gevoeligheid van kankercellen voor straling vergroten. Door de mechanismen van door elektronen geïnduceerde DNA-schade met lage energie te begrijpen, kunnen onderzoekers nieuwe radiosensitizers ontwerpen en ontwikkelen die zich specifiek op deze schadepaden richten, waardoor de effectiviteit van bestralingstherapie wordt vergroot.
Nieuwe therapeutische strategieën verkennen:
Naast radiosensibilisatie kan het modelleren van door elektronen geïnduceerde DNA-schade met lage energie ook leiden tot de ontdekking van innovatieve therapeutische strategieën. Door bijvoorbeeld belangrijke moleculaire doelwitten te identificeren die betrokken zijn bij de vorming en het herstel van DNA-schade, kunnen onderzoekers het potentieel onderzoeken van het manipuleren van deze doelwitten om de tumorgroei te remmen of de stralingsgevoeligheid te vergroten.
Het voorspellen van de reactie van individuele patiënten:
Er bestaan interindividuele variaties in de respons op DNA-schade en de stralingsgevoeligheid als gevolg van genetische verschillen en andere factoren. Door laagenergetische, door elektronen geïnduceerde DNA-schademodellen op te nemen in gepersonaliseerde geneeskundebenaderingen, kan het mogelijk worden om de individuele reacties van patiënten op bestralingstherapie te voorspellen, waardoor de selectie van optimale behandelingsregimes mogelijk wordt.
Samenvattend biedt het modelleren van door elektronen geïnduceerde DNA-schade met lage energie een krachtig hulpmiddel om ons begrip van de fundamentele mechanismen van radiotherapie te vergroten. Door gebruik te maken van deze kennis kunnen onderzoekers effectievere behandelstrategieën ontwikkelen, de toediening van stralingsdosis optimaliseren en uiteindelijk de patiëntresultaten in de strijd tegen kanker verbeteren.
 De waterkwaliteit testen voor een wetenschapsproject
De waterkwaliteit testen voor een wetenschapsproject De voetafdruk verkleinen van een broeikasgas dat krachtiger is dan koolstofdioxide
De voetafdruk verkleinen van een broeikasgas dat krachtiger is dan koolstofdioxide Onderzoekers onthullen structuur en functie van een moleculaire motor
Onderzoekers onthullen structuur en functie van een moleculaire motor Wat zijn de overeenkomsten Metalen & niet-metalen hebben gemeenschappelijk?
Wat zijn de overeenkomsten Metalen & niet-metalen hebben gemeenschappelijk?  Wat is rode fosfor?
Wat is rode fosfor?
Hoofdlijnen
- Wat zijn genetisch gemodificeerde organismen (GGO's)? Zijn ze veilig?
- Spelt of zachte tarwe? Hun diversiteit aan voedingscomponenten verhindert de identificatie welke soort gezonder is
- We moeten de manier waarop antibiotica zich richten op bacteriën veranderen als we willen dat ze blijven werken
- Nieuwe hoop voor ernstig bedreigde aap met stompe neus in Myanmar
- Wie heeft sportdranken uitgevonden?
- Wanneer ontwikkelen baby's liefde voor spraak?
- Genen organiseren zich ruimtelijk voor efficiënte mRNA-splitsing, blijkt uit onderzoek
- Hoe een calciumgevoelig eiwit multitaskt
- Zeebodemlandschap cruciaal voor visbehoud
- Glow-in-the-dark papier als sneltest voor infectieziekten

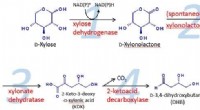
- Metabolic engineering methode slaagt erin om 1, 2, 4-butaantriol duurzaam uit biomassa
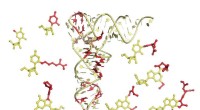
- Nieuwe manier om RNA te zien kan ziekteverwekkers helpen bestrijden
- Machine-learning methode creëert een leerbare chemische grammatica om synthetiseerbare monomeren en polymeren te bouwen
- Nucleatie een zegen voor duurzame nanofabricage

 Teststrips voor kankerdetectie krijgen een upgrade met nanodeeltjes-bling
Teststrips voor kankerdetectie krijgen een upgrade met nanodeeltjes-bling Vreemd fruit:hoe Billie Holidays uitvoering van het anti-lynchlied het zwarte bewustzijn politiseerde
Vreemd fruit:hoe Billie Holidays uitvoering van het anti-lynchlied het zwarte bewustzijn politiseerde  Mede-oprichter van Backpage.com vrijgelaten uit de gevangenis op een borgsom van $ 1 miljoen
Mede-oprichter van Backpage.com vrijgelaten uit de gevangenis op een borgsom van $ 1 miljoen Er is een microklimaat nodig om een pinyonboom te laten groeien
Er is een microklimaat nodig om een pinyonboom te laten groeien Zeldzame zoutformaties verschijnen langs het Great Salt Lake
Zeldzame zoutformaties verschijnen langs het Great Salt Lake Verbeterde excitonmobiliteit die de Mott-Ioffe-Regel-limiet nadert in een 2D Ruddlesden-Popper perovskiet
Verbeterde excitonmobiliteit die de Mott-Ioffe-Regel-limiet nadert in een 2D Ruddlesden-Popper perovskiet  Nieuw lichtgewicht supermateriaal kan kogels bestrijden, ruimtepuin afbuigen
Nieuw lichtgewicht supermateriaal kan kogels bestrijden, ruimtepuin afbuigen De wetenschap achter de splashdown:ruimtevaartingenieur legt uit hoe NASA en SpaceX ruimtevaartuigen veilig terugkrijgen
De wetenschap achter de splashdown:ruimtevaartingenieur legt uit hoe NASA en SpaceX ruimtevaartuigen veilig terugkrijgen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

