
Wetenschap
Ontsnappen aan kinetische vallen:hoe moleculaire interacties het mogelijk maken om de energiebarrière te overwinnen
Verschillende mechanismen waarbij moleculaire interacties betrokken zijn, maken het mogelijk om uit kinetische vallen te ontsnappen. Hier zijn een paar belangrijke mechanismen:
1. Conformationele veranderingen: Moleculaire interacties kunnen conformationele veranderingen in het systeem veroorzaken, waardoor het energielandschap verandert en mogelijk nieuwe routes ontstaan die de energiebarrière verlagen. Deze conformationele veranderingen kunnen worden veroorzaakt door verschillende interacties, zoals waterstofbruggen, hydrofobe interacties of elektrostatische interacties.
2. Tunnelvaren: Kwantumtunneling is een fenomeen waarbij een systeem een energiebarrière kan passeren zonder de benodigde energie te verwerven. Moleculaire interacties kunnen het tunnelen bevorderen door het systeem routes te bieden om door de barrière te "lekken". Dit kan gebeuren wanneer de interacties kwantumtoestanden creëren die verder reiken dan de klassieke energiebarrière, waardoor een niet-klassieke ontsnapping mogelijk is.
3. Thermische activering: Thermische energie kan het systeem de nodige energie leveren om de energiebarrière te overwinnen. In sommige gevallen kan de energiebarrière echter te hoog zijn voor alleen thermische activering. Moleculaire interacties kunnen thermische activering bevorderen door de effectieve energiebarrière te verminderen. Dit kan bijvoorbeeld gebeuren wanneer interacties overgangstoestanden stabiliseren of de energie van de geactiveerde toestand verlagen.
4. Allosterische regulatie: Allosterische interacties omvatten de binding van moleculen aan specifieke plaatsen (allosterische plaatsen) op een eiwit of ander molecuul, wat leidt tot conformationele veranderingen in afgelegen delen van het systeem. Deze conformationele veranderingen kunnen het energielandschap veranderen en de ontsnapping uit kinetische valstrikken vergemakkelijken. Allosterische regulatie wordt vaak waargenomen in biologische systemen, waar het een cruciale rol speelt bij het beheersen van verschillende cellulaire processen.
5. Oplossing en crowding: De aanwezigheid van oplosmiddelmoleculen of macromoleculen (crowding agents) kan het energielandschap beïnvloeden en de ontsnapping uit kinetische vallen beïnvloeden. Solvatie-effecten kunnen bepaalde toestanden stabiliseren en de activeringsbarrières veranderen. Crowding kan ook van invloed zijn op moleculaire interacties en de conformationele dynamiek van het systeem, waardoor mogelijk de ontsnappingsroutes worden beïnvloed.
6. Katalyse: Bij chemische reacties zijn katalysatoren stoffen die de snelheid van een reactie versnellen zonder tijdens het proces te worden verbruikt. Katalysatoren verlagen de energiebarrière van een reactie, waardoor het waarschijnlijker wordt dat de reactanten de overgangstoestand bereiken en producten vormen. Moleculaire interacties tussen de katalysator en de reactanten zijn cruciaal om deze versnelling te bereiken.
Deze mechanismen benadrukken het belang van moleculaire interacties bij het overwinnen van kinetische vallen. Door moleculaire interacties te begrijpen en te manipuleren, wordt het mogelijk strategieën te ontwerpen voor het controleren en faciliteren van de ontsnapping uit metastabiele toestanden, wat aanzienlijke implicaties heeft op gebieden als het ontwerpen van geneesmiddelen, materiaalkunde en biotechnologie.
 Methode om blauw-emitterende nuldimensionale volledig anorganische metaalhalogeniden te ontwikkelen
Methode om blauw-emitterende nuldimensionale volledig anorganische metaalhalogeniden te ontwikkelen Computermodellen bieden nieuw begrip van sikkelcelziekte
Computermodellen bieden nieuw begrip van sikkelcelziekte Onderzoekers ontwikkelen ultrakrachtige plasmonische metaaloxidematerialen
Onderzoekers ontwikkelen ultrakrachtige plasmonische metaaloxidematerialen MiNT-eiwit een nieuw doelwit om ziekte aan te vallen
MiNT-eiwit een nieuw doelwit om ziekte aan te vallen Waarom uien ons aan het huilen maken (en waarom sommigen niet)
Waarom uien ons aan het huilen maken (en waarom sommigen niet)
 Geheimen van de grootste koolstofput op aarde onthuld door synchrotron-onderzoek
Geheimen van de grootste koolstofput op aarde onthuld door synchrotron-onderzoek Hoeveel van het aardse land is landbouwbaar?
Hoeveel van het aardse land is landbouwbaar?
Naarmate de wereldbevolking blijft groeien, kan het uitzoeken hoeveel land beschikbaar is om de steeds groter wordende bevolking te voeden een vervelende probleem worden. Grote hoeveelheden land worden a
 Hoe klimaatverandering nieuwe epidemieën aan het licht zou kunnen brengen
Hoe klimaatverandering nieuwe epidemieën aan het licht zou kunnen brengen  Een betere planning kan het stedelijk hitte-eilandeffect verminderen
Een betere planning kan het stedelijk hitte-eilandeffect verminderen Verdrinkingsangsten in het westen van de VS terwijl rivieren deinen met smeltende sneeuw
Verdrinkingsangsten in het westen van de VS terwijl rivieren deinen met smeltende sneeuw
Hoofdlijnen
- Van druppel tot ontdekking
- Nieuwe ziekte treft bomen in Michigan. Boomverzorgers weten niet hoe ze het moeten behandelen
- Hoe de jacht mensen tot langeafstandslopers heeft gemaakt
- Wat zijn de verschillen tussen een plant en een dierlijke cel onder een microscoop?
- Methode om overvloed te schatten, trends in Noord-Atlantische walvissen bevestigen achteruitgang
- Waarom laten mensen twee sets tanden groeien? Deze buideldieren herschrijven het verhaal van tandheelkundige evolutie
- Levens in evenwicht:waarom houden we vast aan potentieel schadelijke, ziekteverwekkende mutaties?
- Klimaatverandering zal naar verwachting kleiner worden, gestalte van dominante Midwest-plant, studie vondsten
- Genotype: definitie, allelen en voorbeelden
- Team onthult eenvoudige methode om hoogwaardige lithium-seleniumbatterijen te produceren
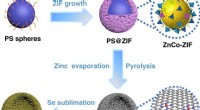
- Onderzoekers ontwikkelen een modulair metaal-organisch raamwerk met de hoogste elektronladingsmobiliteit ooit waargenomen

- Eigenschappen van spinnenzijde geanalyseerd voor gebruik als biogebaseerde vezels in de medische sector

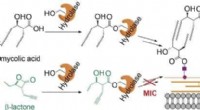
- Antibacteriële bèta-lacton infiltreert in de biosynthese van het mycomembraan en doodt de ziekteverwekker van tuberculose
- Analyseren van de voor- en nadelen van twee composietproductiemethoden

 Interessante feiten over beekjes en rivieren
Interessante feiten over beekjes en rivieren  Metabolische activiteit van bruin vetweefsel gemakkelijker te verifiëren met nieuwe methode
Metabolische activiteit van bruin vetweefsel gemakkelijker te verifiëren met nieuwe methode Nanobuistechnologie leidt tot snelle, goedkope medische diagnostiek
Nanobuistechnologie leidt tot snelle, goedkope medische diagnostiek Techniek stelt onderzoekers in staat om te onderzoeken hoe materialen binden op atomair niveau
Techniek stelt onderzoekers in staat om te onderzoeken hoe materialen binden op atomair niveau Het detecteren van paranoia onder gebruikers van sociale media
Het detecteren van paranoia onder gebruikers van sociale media Baanbrekende röntgenoptica maakt toekomstige observatoria mogelijk
Baanbrekende röntgenoptica maakt toekomstige observatoria mogelijk Feiten en trivia over trigonometrie
Feiten en trivia over trigonometrie  Onderzoekers onthullen nieuwe zonnecel gemaakt van koolstofnanobuisjes die meer zonlicht omzet in energie
Onderzoekers onthullen nieuwe zonnecel gemaakt van koolstofnanobuisjes die meer zonlicht omzet in energie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

