
Wetenschap
Nieuwe inzichten in de aggregatie van antilichamen zullen naar verwachting nieuwe wegen openen voor onderzoek en therapeutische toepassingen
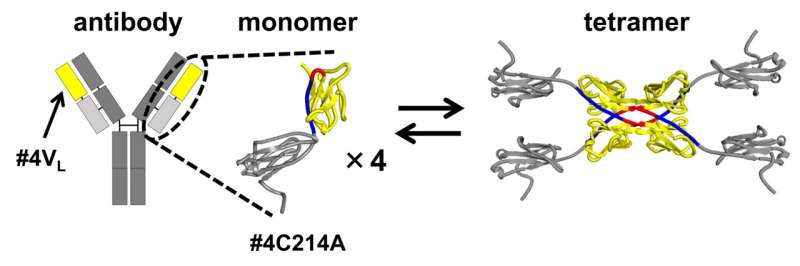
Antilichamen (immunoglobulinen) zijn Y-vormige eiwitten die specifieke ziekteverwekkers herkennen en neutraliseren. Hun vermogen om zich te richten op specifieke moleculen of cellen heeft hen tot veelbelovende kandidaten gemaakt voor de toekomstige ontwikkeling van geneesmiddelen. Hun lichte ketens (delen van het antilichaam die bijdragen aan de herkenning van en binding aan specifieke antigenen) worden echter verkeerd opgevouwen en aggregeren, wat leidt tot amyloïdose, een aandoening die complicaties en weefseldisfunctie in het lichaam veroorzaakt.
In de context van de ontwikkeling van geneesmiddelen kan de aggregatie van antilichamen hun vermogen om zich aan antigenen te binden in gevaar brengen en hun therapeutisch potentieel verminderen. Het gebrek aan gedetailleerde structurele informatie over de aggregatie ervan is echter een van de factoren die de vooruitgang op dit gebied belemmeren.
Als gevolg hiervan zijn de voortdurende inspanningen gericht op het leveren van gedetailleerde rapporten over aggregaatstructuren en hun vormingsmechanismen om de ontwikkeling van antilichaamgeneesmiddelen te bevorderen.
In een onderzoek gepubliceerd in Nature Communications heeft een team van onderzoekers uit Japan, onder leiding van Shun Hirota van het Nara Institute of Science and Technology (NAIST), onlangs nieuwe inzichten verschaft in de structuren die worden gevormd tijdens de aggregatie van antilichamen door middel van 3D-domein swapping (3D-DS), een proces waarbij een specifieke regio van een eiwit wordt uitgewisseld tussen twee of meer moleculen van hetzelfde eiwit.
Het 3D-DS-proces is tot aan het huidige onderzoek waargenomen in verschillende eiwitten, maar niet in de lichte ketens van antilichamen.
In hun onderzoek gebruikten de onderzoekers een aangepaste versie van de lichte keten van antilichamen. In deze gemodificeerde vorm werd een cysteïne (Cys) residu, dat doorgaans een disulfidebinding vormt met een cysteïne met een zware keten, vervangen door alanine (Ala). Dankzij deze wijziging kon het team de structuren die het gevolg waren van 3D-DS isoleren en bestuderen in het segment van het antilichaam dat bijdraagt aan antigeenbinding.
De 3D-DS van de lichte keten van antilichamen omvat de vorming van dimeren (structuren bestaande uit twee identieke subeenheden) en tetrameren (structuren bestaande uit twee dimeren met vier identieke subeenheden).
"Onze studie levert het eerste rapport op over de structuur op atomair niveau van het 3D-DS-fenomeen in het variabele gebied van de lichte keten van een antilichaam", legt Hirota uit.
De grootte-uitsluitingschromatografie van de lichte keten #4C214A van het antilichaam onthulde dat het antilichaam bestaat als individuele monomeren en tetrameren met vier subeenheden. Om het gebied te bepalen waar tetrameren worden gevormd, verdeelden de onderzoekers de lichte keten van het antilichaam in het variabele gebied (de punt van het Y-vormige antilichaam) en het constante gebied (het middelste deel van het Y-vormige antilichaam).
Ze ontdekten dat de variabele regio #4VL kan schakelen tussen monomere en tetramere toestanden.
Verdere analyse met behulp van röntgenkristallografie en thermodynamische simulaties onthulde dat de vorming van tetrameer wordt aangedreven door hydrofobe interacties die plaatsvinden tussen twee 3D-DS-dimeren.
Vergeleken met monomeren bleken de tetrameren stijvere β-sheet-structuren te hebben, waardoor ze minder flexibel zijn. De vorming van het 3D-DS-tetrameer kan eiwitaggregatie helpen voorkomen door de flexibiliteit te verminderen, waardoor mogelijk de vorming van onoplosbare aggregaten wordt vermeden. Aan de andere kant kan 3D-DS de aggregatie van antilichamen bevorderen.
Hirota concludeert:"Deze bevindingen verduidelijken niet alleen de domein-verwisselde structuur van de lichte keten van antilichamen, maar dragen ook bij aan het controleren van de antilichaamkwaliteit en het bevorderen van de ontwikkeling van toekomstige moleculaire herkenningsmiddelen en medicijnen."
Meer informatie: Structurele en thermodynamische inzichten in de vorming van tetrameren van de lichte keten van antilichamen door middel van 3D-domeinwisseling, natuurcommunicatie (2023). DOI:10.1038/s41467-023-43443-4
Aangeboden door Nara Instituut voor Wetenschap en Technologie
 Op afstand bestuurde medicijnafgifte implantaatgrootte van druif kan helpen bij het beheer van chronische ziekten
Op afstand bestuurde medicijnafgifte implantaatgrootte van druif kan helpen bij het beheer van chronische ziekten Tarwegluten kunnen worden gebruikt om duurzaam luiermateriaal te maken
Tarwegluten kunnen worden gebruikt om duurzaam luiermateriaal te maken Water-in-zoutelektrolyt levert stabiele kathode op voor lithium-luchtbatterijen
Water-in-zoutelektrolyt levert stabiele kathode op voor lithium-luchtbatterijen Kleurmix-verfactiviteiten voor kleuters
Kleurmix-verfactiviteiten voor kleuters Ontdekken wat durian doet stinken
Ontdekken wat durian doet stinken
 Overstromingen Indonesië laten bijna 30 doden verschillende ontbrekende
Overstromingen Indonesië laten bijna 30 doden verschillende ontbrekende Convergentiewetenschap in het veranderende Noordpoolgebied
Convergentiewetenschap in het veranderende Noordpoolgebied  Hoe huizen te beschermen tegen natuurbranden is onderwerp van nieuw boek van professoren
Hoe huizen te beschermen tegen natuurbranden is onderwerp van nieuw boek van professoren Aqua-satelliet helpt bij het bevestigen van Subtropische Storm Alpha
Aqua-satelliet helpt bij het bevestigen van Subtropische Storm Alpha Hoe Ohio Wild Mushrooms te identificeren
Hoe Ohio Wild Mushrooms te identificeren
Hoofdlijnen
- Het herprogrammeren van bacteriën in plaats van ze te doden kan het antwoord zijn op antibioticaresistentie
- Endoplasmatisch reticulum:ruw ER versus glad ER
- Hoe snel is een knipoog?
- 15 nieuwe gekkosoorten ontdekt in Myanmar
- Opnieuw geïntroduceerde wolven doden vier jaarlingrunderen tijdens de laatste reeks veeaanvallen in Colorado
- Wetenschappers hebben een appeltje te schillen met paleontologie in videogames
- In het laboratorium gekweekt vlees zou de mensheid een ernstig moreel falen kunnen laten negeren
- Greenpeace laat rotsblokken op de Britse zeebodem vallen om de bodemtrawlvisserij te beteugelen
- Duitsland zegt dat massale vissterfte in de rivier de Oder een door de mens veroorzaakte ramp is
- Schimmelverbinding remt belangrijke groep eiwitten

- Enzymen van schimmels vereenvoudigen de chemische synthese
- Nieuw materiaal van legering van reactorvoering biedt sterkte, weerstand

- Eenvoudige watertest kan verlammende botziekte voorkomen

- Een 3D-beeldvormingstechniek ontgrendelt eigenschappen van perovskietkristallen
 Maanden nodig voor aanvullende studie van Dakota Access-pijplijn
Maanden nodig voor aanvullende studie van Dakota Access-pijplijn De grootte van een graandoos - ESA's eerste satelliet van 2018
De grootte van een graandoos - ESA's eerste satelliet van 2018 Wetenschappers vinden ultradun optisch kristal uit voor lasertechnologie van de volgende generatie
Wetenschappers vinden ultradun optisch kristal uit voor lasertechnologie van de volgende generatie  Ontwikkeling van een lanthaanhexaboride nanodraad-gebaseerd veldemissiekanon met hoge energieresolutie
Ontwikkeling van een lanthaanhexaboride nanodraad-gebaseerd veldemissiekanon met hoge energieresolutie Neutronenbundel van kernreactor gebruikt om veiligere auto's te produceren
Neutronenbundel van kernreactor gebruikt om veiligere auto's te produceren Google-CEO geconfronteerd met House grillen op inbreuk, Chinese censuur
Google-CEO geconfronteerd met House grillen op inbreuk, Chinese censuur Elektronen in actie vangen in een antiferromagnetische nanodraad
Elektronen in actie vangen in een antiferromagnetische nanodraad Toyota ziet Olympisch platform om waterstoftechnologie te stimuleren
Toyota ziet Olympisch platform om waterstoftechnologie te stimuleren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

