
Wetenschap
Onderzoek onthult een reactie die de kern vormt van veel technologieën voor hernieuwbare energie
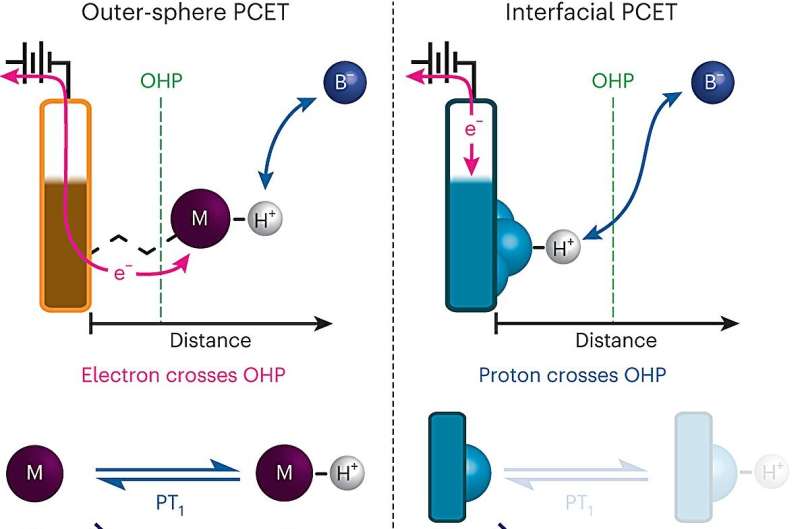
Een belangrijke chemische reactie, waarbij de beweging van protonen tussen het oppervlak van een elektrode en een elektrolyt een elektrische stroom aandrijft, is een cruciale stap in veel energietechnologieën, waaronder brandstofcellen en de elektrolyzers die worden gebruikt om waterstofgas te produceren.
Voor het eerst hebben MIT-chemici in detail in kaart gebracht hoe deze proton-gekoppelde elektronenoverdrachten plaatsvinden op een elektrodeoppervlak. Hun resultaten kunnen onderzoekers helpen efficiëntere brandstofcellen, batterijen of andere energietechnologieën te ontwerpen.
Het onderzoeksartikel is gepubliceerd in het tijdschrift Nature Chemistry .
"Onze vooruitgang in dit artikel was het bestuderen en begrijpen van de aard van hoe deze elektronen en protonen aan het oppervlak paren, wat relevant is voor katalytische reacties die belangrijk zijn in de context van apparaten voor energieconversie of katalytische reacties", zegt Yogesh Surendranath, een onderzoeker. hoogleraar scheikunde en chemische technologie aan het MIT en senior auteur van het onderzoek.
Onder hun bevindingen konden de onderzoekers precies nagaan hoe veranderingen in de pH van de elektrolytoplossing rond een elektrode de snelheid van protonbeweging en elektronenstroom binnen de elektrode beïnvloeden.
MIT-student Noah Lewis is de hoofdauteur van het artikel. Ryan Bisbey, een voormalig MIT-postdoc; Karl Westendorff, een afgestudeerde MIT-student; en Alexander Soudackov, onderzoeker aan de Yale Universiteit, zijn ook auteurs van het artikel.
Protonen doorgeven
Proton-gekoppelde elektronenoverdracht vindt plaats wanneer een molecuul, vaak water of een zuur, een proton overbrengt naar een ander molecuul of naar een elektrodeoppervlak, wat de protonacceptor stimuleert om ook een elektron op te nemen. Dit soort reactie wordt voor veel energietoepassingen benut.
"Deze proton-gekoppelde elektronenoverdrachtsreacties zijn alomtegenwoordig. Ze zijn vaak sleutelstappen in katalytische mechanismen en zijn vooral belangrijk voor energieconversieprocessen zoals waterstofopwekking of brandstofcelkatalyse", zegt Surendranath.
In een waterstofgenererende elektrolyseur wordt deze aanpak gebruikt om protonen uit water te verwijderen en elektronen aan de protonen toe te voegen om waterstofgas te vormen. In een brandstofcel wordt elektriciteit opgewekt wanneer protonen en elektronen uit waterstofgas worden verwijderd en aan zuurstof worden toegevoegd om water te vormen.
Proton-gekoppelde elektronenoverdracht is gebruikelijk bij veel andere soorten chemische reacties; bijvoorbeeld kooldioxidereductie (de omzetting van kooldioxide in chemische brandstoffen door toevoeging van elektronen en protonen). Wetenschappers hebben veel geleerd over hoe deze reacties plaatsvinden als de protonacceptoren moleculen zijn, omdat ze de structuur van elk molecuul nauwkeurig kunnen controleren en kunnen observeren hoe elektronen en protonen ertussendoor passeren.
Wanneer proton-gekoppelde elektronenoverdracht echter plaatsvindt aan het oppervlak van een elektrode, is het proces veel moeilijker te bestuderen, omdat de elektrodeoppervlakken doorgaans zeer heterogeen zijn, met veel verschillende plaatsen waaraan een proton zich mogelijk zou kunnen binden.
Om dat obstakel te overwinnen, heeft het MIT-team een manier ontwikkeld om elektrode-oppervlakken te ontwerpen die hen een veel nauwkeurigere controle geeft over de samenstelling van het elektrode-oppervlak. Hun elektroden bestaan uit lagen grafeen met organische, ringhoudende verbindingen aan het oppervlak. Aan het uiteinde van elk van deze organische moleculen bevindt zich een negatief geladen zuurstofion dat protonen uit de omringende oplossing kan accepteren, waardoor een elektron uit het circuit naar het grafietoppervlak stroomt.
"We kunnen een elektrode maken die niet uit een grote diversiteit aan locaties bestaat, maar uit een uniforme reeks van een enkel type zeer goed gedefinieerde locaties bestaat die elk een proton met dezelfde affiniteit kunnen binden", zegt Surendranath. "Aangezien we deze zeer goed gedefinieerde locaties hebben, konden we hierdoor de kinetiek van deze processen echt ontrafelen."
Met behulp van dit systeem konden de onderzoekers de stroom van elektrische stroom naar de elektroden meten, waardoor ze de snelheid van protonenoverdracht naar het zuurstofion aan het oppervlak bij evenwicht konden berekenen – de toestand waarin de snelheid van protonendonatie aan het oppervlak en protonenoverdracht terug naar de oplossing vanaf het oppervlak zijn gelijk. Ze ontdekten dat de pH van de omringende oplossing een aanzienlijk effect heeft op deze snelheid:de hoogste waarden vonden plaats aan de uiterste uiteinden van de pH-schaal:pH 0, de meest zure, en pH 14, de meest basische.
Om deze resultaten te verklaren, ontwikkelden onderzoekers een model gebaseerd op twee mogelijke reacties die aan de elektrode kunnen optreden. In het eerste geval zijn hydroniumionen (H 3 O + ), die in sterk zure oplossingen in hoge concentraties voorkomen, leveren protonen aan de zuurstofionen aan het oppervlak, waardoor water ontstaat. In het tweede geval levert water protonen aan de zuurstofionen aan het oppervlak, waardoor hydroxide-ionen worden gegenereerd (OH - ), die in hoge concentraties aanwezig zijn in sterk basische oplossingen.
De snelheid bij pH 0 is echter ongeveer vier keer sneller dan die bij pH 14, deels omdat hydronium protonen sneller afgeeft dan water.
Een reactie om te heroverwegen
De onderzoekers ontdekten tot hun verbazing ook dat de twee reacties gelijke snelheden hebben, niet bij een neutrale pH 7, waar de hydronium- en hydroxideconcentraties gelijk zijn, maar bij pH 10, waar de concentratie van hydroxide-ionen 1 miljoen keer zo groot is als die van hydronium. Het model suggereert dat dit komt doordat de voorwaartse reactie waarbij protonendonatie uit hydronium of water betrokken is, meer bijdraagt aan de totale snelheid dan de achterwaartse reactie waarbij protonenverwijdering door water of hydroxide betrokken is.
Bestaande modellen van hoe deze reacties plaatsvinden op elektrodeoppervlakken gaan ervan uit dat de voorwaartse en achterwaartse reacties in gelijke mate bijdragen aan de totale snelheid, dus de nieuwe bevindingen suggereren dat die modellen mogelijk moeten worden heroverwogen, zeggen de onderzoekers.
"Dat is de standaardaanname, dat de voorwaartse en achterwaartse reacties in gelijke mate bijdragen aan de reactiesnelheid", zegt Surendranath. "Onze bevinding is echt eye-openend omdat het betekent dat de veronderstelling die mensen gebruiken om alles te analyseren, van brandstofcelkatalyse tot waterstofevolutie, iets is dat we opnieuw moeten bekijken."
De onderzoekers gebruiken nu hun experimentele opstelling om te bestuderen hoe het toevoegen van verschillende soorten ionen aan de elektrolytoplossing rond de elektrode de snelheid van de proton-gekoppelde elektronenstroom kan versnellen of vertragen.
"Met ons systeem weten we dat onze locaties constant zijn en elkaar niet beïnvloeden, zodat we kunnen uitlezen wat de verandering in de oplossing doet met de reactie aan de oppervlakte", zegt Lewis.
Meer informatie: Noah B. Lewis et al, Een mechanistisch raamwerk op moleculair niveau voor grensvlakproton-gekoppelde elektronenoverdrachtskinetiek, Natuurchemie (2024). DOI:10.1038/s41557-023-01400-0
Journaalinformatie: Natuurchemie
Aangeboden door Massachusetts Institute of Technology
Dit verhaal is opnieuw gepubliceerd met dank aan MIT News (web.mit.edu/newsoffice/), een populaire site met nieuws over MIT-onderzoek, innovatie en onderwijs.
 Eigenschappen van het Bose Einstein-condensaat
Eigenschappen van het Bose Einstein-condensaat Ingenieurs maken een eenvoudige test die stresshormonen in zweet kan meten, bloed, urine of speeksel
Ingenieurs maken een eenvoudige test die stresshormonen in zweet kan meten, bloed, urine of speeksel Capaciteit van dunne films die gepolymeriseerde ionische vloeistoffen bevatten
Capaciteit van dunne films die gepolymeriseerde ionische vloeistoffen bevatten Fotokatalysator maakt waterstofproductie 10 keer efficiënter
Fotokatalysator maakt waterstofproductie 10 keer efficiënter Eukaryoten vereisen zuurstof?
Eukaryoten vereisen zuurstof?
 Satelliet- en heranalysegegevens kunnen veldwaarnemingen over de Aziatische watertoren vervangen
Satelliet- en heranalysegegevens kunnen veldwaarnemingen over de Aziatische watertoren vervangen Oost-Aziatische warmwaterbron gekoppeld aan de anomalie van de oppervlaktetemperatuur van de Atlantische Oceaan
Oost-Aziatische warmwaterbron gekoppeld aan de anomalie van de oppervlaktetemperatuur van de Atlantische Oceaan Waarom duiken plastic flessen in tijdens koud weer?
Waarom duiken plastic flessen in tijdens koud weer?  Flash-droogten vormen een uitdaging voor waarschuwingssysteem
Flash-droogten vormen een uitdaging voor waarschuwingssysteem Online visualisatietool biedt een nieuw venster op stijgende zeeën
Online visualisatietool biedt een nieuw venster op stijgende zeeën
Hoofdlijnen
- Tabaksplanten als levensredders
- Is Rust Dust schadelijk?
- Dierenartsen voeren de eerste bekende hersenoperatie uit om hydrocephalus bij pelsrobben te behandelen
- Wat zijn de vier organische moleculen in levende dingen?
- De reden voor incubatie bij verschillende temperaturen in de microbiologie
- Wetenschappers ontgrendelen de code om betere erwten te kweken
- Leeft de buff-breasted button-kwartel nog? Dit eeuwenoude vogelmysterie moet nog worden opgelost
- Voorbeelden van een recessief allel
- Verbeterde CRISPR-methode maakt stabiele invoeging van grote genen in het DNA van hogere planten mogelijk
- Synthese van biobased high-performance polyamide uit biogene residuen
- Nieuwe katalysator helpt koolstofdioxide om te zetten in brandstof

- Laat er licht zijn:Organische verbindingen synthetiseren
- Onderzoekers passen een snelle en effectieve strategie voor verrijking van N-fosfopeptiden aan
- Ringvormige multi-koolstofverbinding cyclocarbon gesynthetiseerd

 Nieuwe MAVEN-bevindingen onthullen hoe de atmosfeer van Mars verloren ging in de ruimte
Nieuwe MAVEN-bevindingen onthullen hoe de atmosfeer van Mars verloren ging in de ruimte Studie onderzoekt waarom volwassen kinderen de banden met ouders verbreken
Studie onderzoekt waarom volwassen kinderen de banden met ouders verbreken Hoe te bepalen of een hoofdvogel mannelijk of vrouwelijk is
Hoe te bepalen of een hoofdvogel mannelijk of vrouwelijk is Een microringresonator met groot potentieel:hybride apparaat verbetert de lasertechnologie aanzienlijk
Een microringresonator met groot potentieel:hybride apparaat verbetert de lasertechnologie aanzienlijk  Het bevorderen van tijdelijke contracten heeft niet het gewenste effect van het vergroten van de werkgelegenheid
Het bevorderen van tijdelijke contracten heeft niet het gewenste effect van het vergroten van de werkgelegenheid Hoe Linearity te testen in SPSS
Hoe Linearity te testen in SPSS  VS kijken naar alternatieve sancties voor China's ZTE:Ross
VS kijken naar alternatieve sancties voor China's ZTE:Ross Planten in de Canopy Layer of the Rainforest
Planten in de Canopy Layer of the Rainforest
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

