
Wetenschap
Verbeterde CRISPR-methode maakt stabiele invoeging van grote genen in het DNA van hogere planten mogelijk
Wetenschappers van het Leibniz Instituut voor Plantenbiochemie (IPB) zijn er voor het eerst in geslaagd om op stabiele en nauwkeurige wijze grote gensegmenten zeer efficiënt in het DNA van hogere planten in te brengen. Om dit te doen, hebben ze de methode voor het bewerken van genen CRISPR/Cas geoptimaliseerd, beter bekend als 'genetische schaar'.
De verbeterde CRISPR-methode biedt grote kansen voor het gericht aanpassen van genen in hogere planten, zowel voor de veredeling als voor onderzoek. De studie, geleid door prof. Alain Tissier en dr. Tom Schreiber, is gepubliceerd in Molecular Plant .
CRISPR/Cas is een methode met enorme potentie voor het gericht aanpassen van individuele genen. Dit geldt echter niet voor alle soorten genetische modificaties die veredelaars en wetenschappers op hun verlanglijstje hebben staan. Hoewel de genetische schaar ideaal is voor het uitschakelen van genen, dat wil zeggen het uitschakelen of verwijderen van bestaande genen, werkt ze niet goed voor het nauwkeurig inbrengen van genen of het vervangen van gensegmenten. Tot nu toe zijn genetische scharen te inefficiënt en daardoor weinig bruikbaar voor het doelgericht inbrengen van genen in het DNA van hogere planten.
"De reden hiervoor zijn de interne reparatiemachines van de fabriek voor DNA-breuken", zegt Schreiber. Deze reparatie-enzymen zijn direct aanwezig zodra er schade aan het DNA ontstaat. Ze herkennen ook de gladde sneden gemaakt door de genetische schaar en voegen zich onmiddellijk weer bij de twee afgesneden DNA-strengen van de dubbele helix. Dit aan elkaar lijmen van het geknipte DNA gebeurt zeer snel en niet erg nauwkeurig; er zijn kleine informatieverliezen waarbij kleine stukjes DNA verloren gaan of worden toegevoegd.
‘Deze onnauwkeurigheden vormen bij knock-outprojecten geen probleem en zijn zelfs wenselijk’, zegt Schreiber, ‘omdat ik het gen toch wil uitschakelen. Maar als ik een gen wil inbrengen, moet dat heel precies gebeuren. genetische informatie moet precies worden ingevoegd, geen enkel onderdeel mag ontbreken en geen enkel extra onderdeel mag worden geïntegreerd, anders verliest het gen zijn functie en is het hele experiment voor niets geweest."
Om deze reden is CRISPR/Cas-gemedieerde precieze en littekenvrije insertie van grotere genen of DNA-segmenten tot nu toe slechts in zeldzame individuele gevallen succesvol geweest. Om het succespercentage van gen-insertie te vergroten, hebben de Halle-wetenschappers de genetische schaar uitgerust met een extra enzym, een zogenaamd exonuclease.
Exonucleasen kunnen de door de genetische schaar gecreëerde DNA-splitsingsplaatsen zodanig veranderen dat de interne reparatie-enzymen van de cel de DNA-schade niet langer kunnen herkennen en herstellen. Het door CRISPR/Cas in te brengen DNA-segment zou daardoor voldoende tijd hebben om zichzelf op de juiste positie te integreren via een ander, zeer nauwkeurig, cellulair reparatiemechanisme.
In het experiment testten de Halle-wetenschappers verschillende exonucleasen van virale, bacteriële, plantaardige en menselijke oorsprong op hun vermogen om het aantal precieze gen-insertiegebeurtenissen te vergroten. Ze introduceerden de genetische schaar met de bijbehorende exonucleasen en een gen X-segment in de bladcellen van de tabaksplant Nicotiana benthamiana.
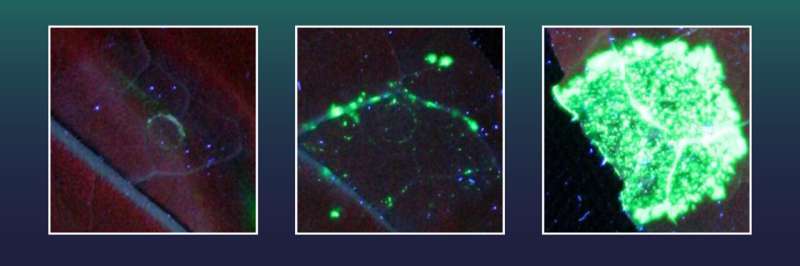
Deze tabakscellen waren eerder uitgerust met een gen voor een groen fluorescerende marker. Ze bevatten ook een vernietigd gen X, dat nodig is voor de vorming van de groen fluorescerende kleurstof. De fluorescerende marker kan echter niet worden gegenereerd zolang een groot deel van de genetische informatie van gen X ontbreekt.
De groene marker kan alleen worden geproduceerd als het ontbrekende gengedeelte van X nauwkeurig opnieuw wordt ingebracht met behulp van CRISPR/Cas, waardoor gen X wordt gerepareerd. Elke cel met succesvolle geninsertie zal dan groen fluoresceren en onderzoekers kunnen eenvoudigweg het aantal succesvolle geninsertie-gebeurtenissen tellen. .
Twee van de geteste exonucleasen, waaronder één uit de herpesvirusfamilie, bleken bijzonder effectief. Met behulp hiervan bereikte het team uit Halle 38 keer meer perfecte gen-insertie-evenementen dan alleen met CRISPR/Cas.
Deze experimentele aanpak werd vervolgens getest met andere genen die moesten worden ingebouwd en in andere planten, namelijk zandraket (Arabidopsis thaliana) en tarwe. Omdat de gen-insertie in de tabaksplanten alleen lokaal in de bladeren plaatsvond, ging het geïntegreerde gen verloren bij de volgende dochtergeneratie en was het daarom slechts een beperkte tijd in het genoom aanwezig.
Dit is de reden waarom de CRISPR-experts van Halle in Arabidopsis en tarwe probeerden het gen in kiembaancellen te incorporeren om een stabiele erfenis voor toekomstige plantengeneraties te garanderen. Met behulp van de geteste exonucleasen bleek de stabiele, d.w.z. erfelijke, knock-in van genen succesvol bij Arabidopsis met een tienvoudige toename in frequentie en bij tarwe bij ruim 1% van de dochterplanten.
"Eén procent lijkt in eerste instantie niet veel", legt Schreiber uit, "maar als een veredelaar een bepaalde eigenschap in zijn plant wil introduceren, hoeft hij maar zo'n 50-100 dochterplanten van de eerste generatie te screenen met behulp van onze geoptimaliseerde CRISPR. /Cas-methode om een plant met de gewenste eigenschap te vinden. Dit zou een aanzienlijke tijdsbesparing opleveren ten opzichte van conventionele veredelingsmethoden, waarbij hiervoor 500 tot 1.000 planten geanalyseerd zouden moeten worden."
Daarom is de geoptimaliseerde CRISPR/Cas-methode een veelbelovend hulpmiddel voor het gericht inbrengen van genen in hogere planten en mogelijk ook in andere organismen. In de toekomst zouden plantenveredelaars deze methode bijvoorbeeld kunnen gebruiken om verloren resistentiegenen tegen ziekteverwekkers van wilde soorten of oude gecultiveerde variëteiten te herintroduceren in moderne, hoogproductieve elitevariëteiten. Op die manier kunnen dergelijke wenselijke eigenschappen de plantenveredeling verbeteren en bijdragen aan de ontwikkeling van robuustere gewasvariëteiten.
Voor de wetenschap biedt deze aanpak grote mogelijkheden om in één stap op elegante wijze bepaalde plantengenen te vervangen door gemodificeerde kopieën van zichzelf. Dit is vooral nuttig bij het ophelderen van de genfunctie.