
Wetenschap
Chemische touwtruc op moleculair niveau:Mechanismeonderzoek helpt als vallen en opstaan mislukt
Bij de meeste industriële chemische reacties combineren katalysatoren zich met de uitgangsmaterialen en begeleiden deze via tussenstappen naar het product. In de scheikunde staat deze route bekend als het reactiemechanisme, en het is een soort zwarte doos:niemand weet in eerste instantie wat er op moleculair niveau gebeurt.
Als het reactieresultaat in het laboratorium niet aan de verwachtingen voldoet, nemen scheikundigen eerst hun toevlucht tot vallen en opstaan. Simpel gezegd:ze passen de reactie aan totdat deze werkt. Soms is het echter de moeite waard om het reactiemechanisme nader te bekijken, zoals Dr. Nora Jannsen van het Leibniz Instituut voor Katalyse in Rostock laat zien aan de hand van een modelreactie.
Haar bevindingen, die ze behaalde als onderdeel van haar doctoraat, publiceerde ze onlangs in het Journal of the American Chemical Society .
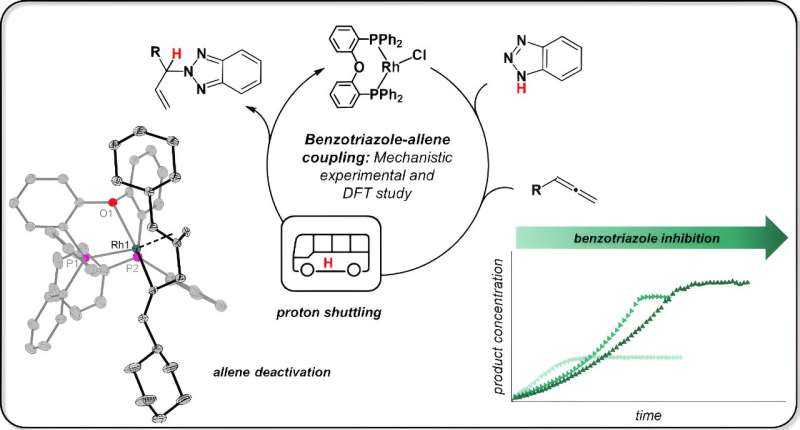
De modelreactie klinkt weinig spectaculair en vooral vreemd in de oren van de leek, legt Jannsen uit. "Benzotriazool, meestal een corrosieremmer, wordt met een alleen (de nadruk ligt hier op de tweede lettergreep) omgezet in een nieuwe stof met behulp van een rhodiumkatalysator." Dit wordt dan allylbenzotriazool genoemd en kan in verschillende syntheses worden gebruikt. De reactie is ontwikkeld door een onderzoeksgroep onder leiding van prof. Breit van de Universiteit van Freiburg.
Functionele groep nauwkeurig ingesteld
De collega's in Freiburg slaagden erin een ‘functionele groep’ nauwkeurig te koppelen aan een zeer specifieke positie in benzotrialzol. Dit is waar een stikstof-waterstofbinding (N-H) zich bevindt, zoals Jannsen uitlegt.
"Functionele groepen" zijn belangrijk als moleculaire segmenten omdat ze verantwoordelijk zijn voor het specifieke, bijvoorbeeld farmaceutische, effect.
"Het team uit Freiburg wilde zo'n groep in benzotriazol plaatsen, precies daar waar de N-H-binding zich bevindt, en de N-H-binding moet hiervoor plaats maken", vervolgt Jannsen. Dit is de collega's gelukt. "Maar ze begrepen niet op welke basis ze dit hadden bereikt."
Dat is jammer. Want alleen met inzicht in de moleculaire gebeurtenissen kan de reactie in de toekomst specifiek worden toegepast en geoptimaliseerd. Dit was het doel van Jannsens proefschrift, dat ze in 2023 met succes verdedigde in Rostock.
Idee:Katalysator verbreekt de binding
Dus hoe werkt zo’n reactie? Het begin en einde zijn bekend. Wat ook bekend is over deze reactie is dat elk afzonderlijk atoom uit de uitgangsmaterialen later in het product wordt aangetroffen; scheikundigen noemen dit een ‘atoom-economische’ reactie. Dit betekent dat in de loop van de reactie de waterstof uit de N-H-binding van het benzotriazool naar het tweede uitgangsmateriaal, het alleen, moet gaan.
Jannsen zegt:"De wetenschappers uit Freiburg dachten dat de katalysator de stikstof-waterstofbinding verbreekt, dat wil zeggen dat er een zogenaamde oxidatieve toevoeging van het benzotriazool plaatsvindt. Rhodium-katalysatoren staan bekend om dit soort reacties."
Jannsen testte het idee door de rhodiumkatalysator eerst te laten reageren met slechts één uitgangsmateriaal, benzotriazool. Ze isoleerde monsters uit deze reactie voor nucleaire magnetische resonantiespectroscopie (NMR) en röntgenkristalstructuuranalyse. Het resultaat:"De NH-binding wordt helemaal niet verbroken. Het benzotriazool blijft volledig intact, het hecht zich alleen aan de katalysator."
Resultaat:eenvoudige coördinatie
De scheikundige ontdekte vervolgens dat de tweede uitgangsstof, allen, ook aan de katalysator bindt. En dit is waar het volgende gebeurt:“De twee uitgangsmaterialen komen in direct contact met elkaar, en de benzotriazool brengt het waterstofatoom, ook wel proton genoemd, over naar het alleen. De katalysator houdt alleen de uitgangsmaterialen op hun plaats, maar komt niet rechtstreeks tussenbeide in deze stap."
Jannsen heeft dit voorstel vervolgens gedetailleerd onderbouwd met behulp van de kwantummechanica, dat wil zeggen door het reactiepad theoretisch te modelleren.
Jannsen was verrast dat de middelman de hele zaak zo eenvoudig voor elkaar kreeg. Voor leken klinkt het misschien een beetje als een chemische touwtruc. In technische termen is een dergelijk proces algemeen bekend en wordt het protonatie genoemd.
Dit proces had een voordeel. Jannsen zegt:"Interessant genoeg kunnen de reactieomstandigheden voor protonering aanzienlijk worden verbeterd door nog een protonenbron toe te voegen." Zo slaagde ze erin de reactietemperatuur te verlagen van 80°C naar kamertemperatuur door een soort co-katalysator toe te voegen.
Veel helpt niet altijd veel
Jannsen ontdekte ook dat de benzotriazool onder bepaalde omstandigheden de katalysator ook kan blokkeren. Dit is het geval wanneer deze uitgangsstof tweemaal de katalysator in beslag neemt, waardoor zijn reactiepartner, de allen, geen vrije ruimte op de katalysator kan vinden.
Dit verlamt de katalytische activiteit en leidt ertoe dat de katalysator wordt "geconsumeerd". "Waarschijnlijk helpt het hier om simpelweg achtereenvolgens het uitgangsmateriaal aan de reactie toe te voegen, zodat de katalysator er minder mee in contact komt", zegt Jannsen.