
Wetenschap
Een nieuwe op suiker gebaseerde katalysator zou een potentiële oplossing kunnen bieden voor het gebruik van afgevangen koolstof
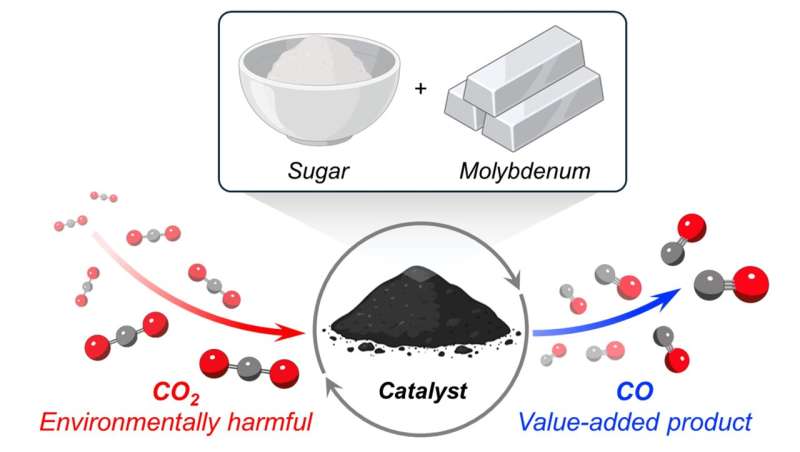
Een nieuwe katalysator gemaakt van een goedkoop, overvloedig metaal en gewone tafelsuiker heeft de kracht om kooldioxide (CO2) te vernietigen ) gas.
In een nieuw onderzoek van de Northwestern University heeft de katalysator met succes CO2 omgezet omgezet in koolmonoxide (CO), een belangrijke bouwsteen voor de productie van een verscheidenheid aan nuttige chemicaliën. Wanneer de reactie plaatsvindt in aanwezigheid van waterstof, bijvoorbeeld CO2 en waterstof wordt omgezet in synthesegas (of syngas), een zeer waardevolle voorloper voor de productie van brandstoffen die mogelijk benzine kunnen vervangen.
Met de recente vooruitgang op het gebied van koolstofafvangtechnologieën wordt koolstofafvang na verbranding een plausibele optie om de mondiale klimaatveranderingscrisis te helpen aanpakken. Maar hoe om te gaan met de afgevangen koolstof blijft een open vraag. De nieuwe katalysator zou mogelijk een oplossing kunnen bieden voor de verwijdering van het krachtige broeikasgas door het om te zetten in een waardevoller product.
De studie, getiteld "Een actieve, stabiele kubieke molybdeencarbidekatalysator voor de omgekeerde water-gas shift-reactie bij hoge temperatuur", is gepubliceerd in het tijdschrift Science .
"Zelfs als we zouden stoppen met het uitstoten van CO2 nu zou onze atmosfeer nog steeds een overschot aan CO2 hebben als gevolg van industriële activiteiten uit de afgelopen eeuwen', zegt Milad Khoshooei van Northwestern, die het onderzoek mede leidde.
"Er bestaat niet één oplossing voor dit probleem. We moeten de CO2 verminderen uitstoot en nieuwe manieren vinden om de CO2 te verminderen concentratie die zich al in de atmosfeer bevindt. We moeten profiteren van alle mogelijke oplossingen."
"Wij zijn niet de eerste onderzoeksgroep die CO2 omzet naar een ander product”, zegt Omar K. Farha van Northwestern, senior auteur van het onderzoek. “Om het proces echt praktisch te laten zijn, is er echter een katalysator nodig die aan verschillende cruciale criteria voldoet:betaalbaarheid, stabiliteit, productiegemak en schaalbaarheid. Het balanceren van deze vier elementen is essentieel. Gelukkig blinkt ons materiaal uit in het voldoen aan deze eisen.”
Farha, een expert op het gebied van koolstofafvangtechnologieën, is Charles E. en Emma H. Morrison hoogleraar scheikunde aan het Weinberg College of Arts and Sciences in Northwestern. Na het starten van dit werk als Ph.D. kandidaat aan de Universiteit van Calgary in Canada, Khohooi is nu een postdoctoraal onderzoeker in het laboratorium van Farha.
Oplossingen uit de voorraadkast
Het geheim achter de nieuwe katalysator is molybdeencarbide, een extreem hard keramisch materiaal. In tegenstelling tot veel andere katalysatoren waarvoor dure metalen nodig zijn, zoals platina of palladium, is molybdeen een goedkoop, niet-kostbaar metaal dat veel op aarde voorkomt.
Om molybdeen om te zetten in molybdeencarbide hadden de wetenschappers een koolstofbron nodig. Ze ontdekten een goedkope optie op een onverwachte plek:de voorraadkast. Verrassend genoeg diende suiker (de witte, gegranuleerde soort die in bijna elk huishouden te vinden is) als een goedkope, handige bron van koolstofatomen.
"Elke dag dat ik deze materialen probeerde te synthetiseren, bracht ik suiker vanuit mijn huis naar het laboratorium", zei Khohooi. "Vergeleken met andere materiaalklassen die gewoonlijk voor katalysatoren worden gebruikt, zijn de onze ongelooflijk goedkoop."
Succesvol selectief en stabiel
Bij het testen van de katalysator waren Farha, Khoshooei en hun medewerkers onder de indruk van het succes ervan. De katalysator werkte bij omgevingsdruk en hoge temperaturen (300–600 graden Celsius) en zette CO2 om in CO met 100% selectiviteit.
Hoge selectiviteit betekent dat de katalysator alleen op CO2 inwerkt zonder omliggende materialen te verstoren. Met andere woorden:de industrie zou de katalysator kunnen toepassen op grote volumes afgevangen gassen en zich selectief alleen op de CO2 kunnen richten. . De katalysator bleef ook in de loop van de tijd stabiel, wat betekent dat hij actief bleef en niet afbrak.
"In de scheikunde is het niet ongebruikelijk dat een katalysator na een paar uur zijn selectiviteit verliest", zegt Farha. "Maar na 500 uur onder zware omstandigheden veranderde de selectiviteit niet."
Dit is vooral opmerkelijk omdat CO2 is een stabiel (en koppig) molecuul.
"CO2 omzetten is niet gemakkelijk', zei Khohooi. 'CO2 is een chemisch stabiel molecuul, en we moesten die stabiliteit overwinnen, wat veel energie kost."
Tandemaanpak voor het opruimen van koolstof
Het ontwikkelen van materialen voor het afvangen van koolstof is een belangrijk aandachtspunt van Farha's laboratorium. Zijn groep ontwikkelt metaal-organische raamwerken (MOF's), een klasse van zeer poreuze materialen van nanogrootte die Farha vergelijkt met 'verfijnde en programmeerbare badsponzen'. Farha onderzoekt MOF's voor diverse toepassingen, waaronder het opvangen van CO2 rechtstreeks uit de lucht.
Nu zegt Farha dat MOF's en de nieuwe katalysator zouden kunnen samenwerken om een rol te spelen bij het afvangen en vastleggen van koolstof.
"Op een gegeven moment zouden we een MOF kunnen inzetten om CO2 af te vangen , gevolgd door een katalysator die het omzet in iets nuttigers," opperde Farha. "Een tandemsysteem dat twee verschillende materialen gebruikt voor twee opeenvolgende stappen zou de weg vooruit kunnen zijn."
“Dit zou ons kunnen helpen de vraag te beantwoorden:‘Wat doen we met afgevangen CO2 ?'" Khohooi voegde toe.
"Op dit moment is het plan om het ondergronds op te slaan. Maar ondergrondse reservoirs moeten aan veel eisen voldoen om CO2 veilig en permanent op te slaan. . We wilden een meer universele oplossing ontwerpen die overal kan worden gebruikt en tegelijkertijd economische waarde toevoegt."