
Wetenschap
Het vinden van de kier in het pantser van het coronavirus – experiment onthult hoe het belangrijkste protease van SARS-CoV-2 zichzelf beschermt
De COVID-19-pandemie heeft geleid tot miljoenen doden. Ondanks een ongeëvenaarde gezamenlijke onderzoeksinspanning die heeft geleid tot de productie van effectieve vaccins en therapieën in recordtijd, ontbreekt het nog steeds aan een volledig begrip van de structuur en levenscyclus van het coronavirus, bekend als SARS-CoV-2.
Wetenschappers gebruikten de biolabs en het SPB/SFX-instrument van de Europese XFEL om de belangrijkste protease, of Mpro, van het virus te bestuderen om te begrijpen hoe het zichzelf beschermt tegen oxidatieve schade. De resultaten voegen belangrijke kennis toe aan ons begrip van de werking van SARS-CoV-2 en het gebied van virale biologie.
Het artikel is gepubliceerd in het tijdschrift Nature Communications .
Tussen januari 2020 en maart 2023 stierven ruim zes miljoen mensen als gevolg van de luchtwegziekte COVID-19, en raakten enkele honderden miljoenen mensen besmet. De ziekte wordt veroorzaakt door SARS-CoV-2, een coronavirus.
“Coronavirussen zijn een groep RNA-virussen die ziekten en aandoeningen veroorzaken bij zoogdieren en vogels”, legt de Europese XFEL-wetenschapper Richard Bean uit. “Ondanks hun aanzienlijke relevantie voor de mondiale menselijke gezondheid valt er echter nog veel te leren over de structuur en functie van coronavirussen in het algemeen en SARS-CoV-2 in het bijzonder.”
Als reactie op het uitbreken van de pandemie hebben wetenschappers en wetenschappelijke organisaties over de hele wereld hun best gedaan om de structuur, dynamiek en functie van SARS-CoV-2 te bestuderen op zoek naar vaccins en therapieën. Vanwege zijn centrale rol in de replicatiecyclus van het virus, kwam het belangrijkste protease – een enzym dat nieuw gemaakte stukjes van het virus van elkaar bevrijdt – al snel naar voren als een belangrijk doelwit voor antivirale geneesmiddelen.
Het belangrijkste protease, of Mpro, is bijzonder aantrekkelijk voor de ontwikkeling van geneesmiddelen omdat het een centrale rol speelt bij de virale replicatie, en ook omdat het behoorlijk verschilt van alle menselijke eiwitten. Hierdoor kunnen therapieën zich specifiek op het virus richten en tegelijkertijd de bijwerkingen die patiënten zouden kunnen schaden, minimaliseren. Eerdere programma's voor het ontdekken van geneesmiddelen die zich op andere virussen richtten, zijn succesvol gebleken met behulp van virale proteaseremmers, waardoor een succesvol resultaat in het geval van SARS-CoV-2 waarschijnlijker wordt.
“Hoewel het hoogtepunt van de COVID-19-pandemie misschien voorbij is, schuilt er nog steeds veel waarde in het bestuderen van het SARS-CoV-2-virus”, zegt Thomas Lane van het Center for Free-Electron Laser Science (CFEL) in Hamburg. "COVID blijft wereldwijd een aanzienlijke bedreiging voor de gezondheid vormen. Gezien de persistentie van dit virus en de mogelijke opkomst van toekomstige pathogene coronavirussen, is het absoluut noodzakelijk dat we een dieper inzicht ontwikkelen in Mpro en zijn rol in de virale functie."
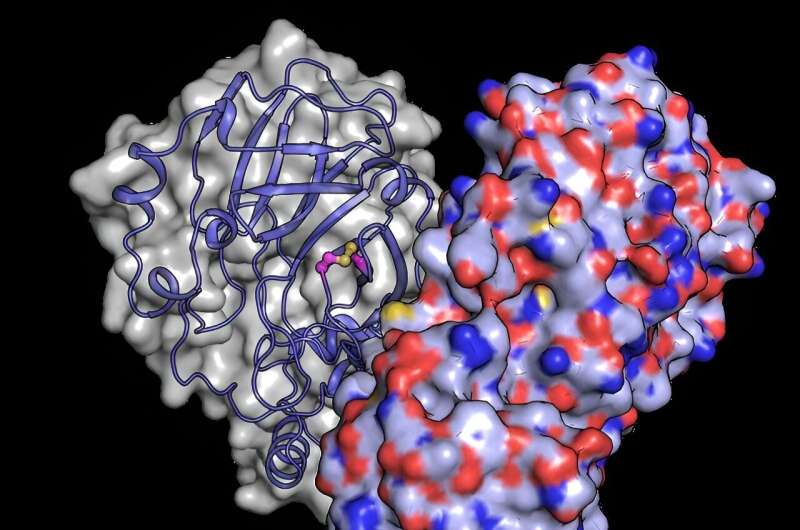
In een recent experiment met het SPB/SFX-instrument van de Europese XFEL gebruikten Lane en collega's de intense röntgenbundel om Mpro te bestuderen. Verschillende eerdere structuurstudies gericht op Mpro hebben een aantal bijzonderheden aan het licht gebracht.
"Ten eerste vormt het eiwit een 3D-structuur die bekend staat als een dimeer wanneer het in hoge concentraties wordt aangetroffen", legt de Europese XFEL-wetenschapper Robin Schubert uit, die bij het experiment betrokken was. "Deze structurele gewoonte lijkt de activiteit ervan rechtstreeks te beïnvloeden, maar we weten niet precies waarom dit belangrijk is voor het virus." Naast belangrijke inzichten in de 3D-structuur hebben recente onderzoeken ook gewezen op het belang van cellulaire zuurstofniveaus voor proteaseactiviteit.
"Het lijkt erop dat zelfs milde blootstelling aan zuurstof de activiteit van Mpro vermindert", legt Patrick Reinke uit, ook van CFEL. Bij aanwezigheid van voldoende zuurstof stopt de omzet zelfs helemaal. Maar dit proces is omkeerbaar:als de zuurstof wordt verwijderd, reactiveert het enzym zichzelf, wat erop wijst dat het systeem beschermende mechanismen heeft ontwikkeld om te overleven in een oxidatieve omgeving.
"Het is aangetoond dat oxidatieve stress de functie van andere virussen, zoals HIV, reguleert", voegt Reinke toe. "Er is gesuggereerd dat structurele veranderingen in het protease het laten ontsnappen aan oxidatieve schade in zuurstofrijke omgevingen. We zijn er echter nog steeds niet zeker van hoe deze beschermende mechanismen de virale fitheid beïnvloeden."
Om beter te begrijpen hoe structurele veranderingen het eiwit beschermen tegen zuurstofschade, gebruikte het team de krachtige röntgenstraal van de Europese XFEL om de structuur van Mpro bloot te leggen nadat het aan zuurstof was blootgesteld. Ze ontdekten een structurele herschikking van Mpro waarbij zich een binding vormt tussen twee cysteïneresiduen:cysteïne C145 op de actieve plaats en een distale cysteïne C117.
Om dit te bereiken produceerde het team in de loop van enkele maanden grote hoeveelheden Mpro in de biolabs van het Europese XFEL en veranderde het in microkristallen, waarvan sommige werden gekweekt in de aanwezigheid van zuurstof. Ten slotte werden de microkristallen met behulp van een vloeistofstraal voor de Europese XFEL-straal naar het SPB/SFX-instrument gestuurd.
Dergelijke kleine kristallen zijn onmogelijk te bestuderen met traditionele lichtbronnen, omdat de hoeveelheid straling die nodig is om voldoende gegevens uit de kristallen te genereren ze zou vernietigen. De röntgenpulsen die door de Europese XFEL worden geproduceerd, zijn echter zo krachtig en kort dat ze kunnen worden gebruikt om een beeld te krijgen van het eiwitkristal voordat het de tijd heeft om uiteen te vallen.
"Onze resultaten laten zien dat cysteïne op de actieve plaats, dat de chemie van het enzym regelt, zichzelf stiekem kan verbergen voor oxidatieve schade", zegt Schubert. Doorgaans kan oxidatie cysteïnes onomkeerbaar beschadigen.
Bij oxidatie beschermt Mpro echter zijn belangrijkste cysteïne door de vorming van een zogenaamde 'disulfidebinding', die het in de kern van de eiwitstructuur begraaft. Als de disulfidebinding vervolgens wordt teruggebracht naar een veilige, zuurstofarme omgeving, kan deze breken, waardoor het actieve cysteïne vrijkomt, dat zijn oorspronkelijke functie hervat.
"De experimenten uitgevoerd bij de Europese XFEL onthullen een beeld van het eiwit in zijn verborgen disulfidestaat, bevestigen het bestaan ervan en onthullen hoe het werkt", zegt Schubert.
"Mpro vertoont een ongewoon rijke reeks oxidatiemodificaties, en ons experiment voegt een sleutelstuk toe aan dat verhaal", zegt Lane. De wetenschappers zijn enthousiast over wat hun gegevens aangeven en over hun volgende stappen. “Mpro is een spil in de biologie van het coronavirus en het belangrijkste doelwit voor anti-COVID-19-therapieën met kleine moleculen.
“Er is aangetoond dat de functie van het enzym wordt gereguleerd via zowel dimerisatie als oxidatie, en het is duidelijk dat deze regulerende mechanismen biofysisch gecorreleerd zijn. Hoewel onze structuren mechanistisch inzicht bieden in deze eigenschappen van Mpro, moeten we nu begrijpen hoe regulatie op basis van oxidatieve stress of eiwitconcentratie heeft invloed op de virale fitheid. Dit zal een dieper inzicht verschaffen in de virale biologie en hopelijk nieuwe mogelijkheden openen om die biologie te verstoren met levensreddende medicijnen."