Wetenschap
Het dubbele leven van Sp1:een nieuwe rol van eiwitten zet het denken over de impact ervan op kanker op zijn kop
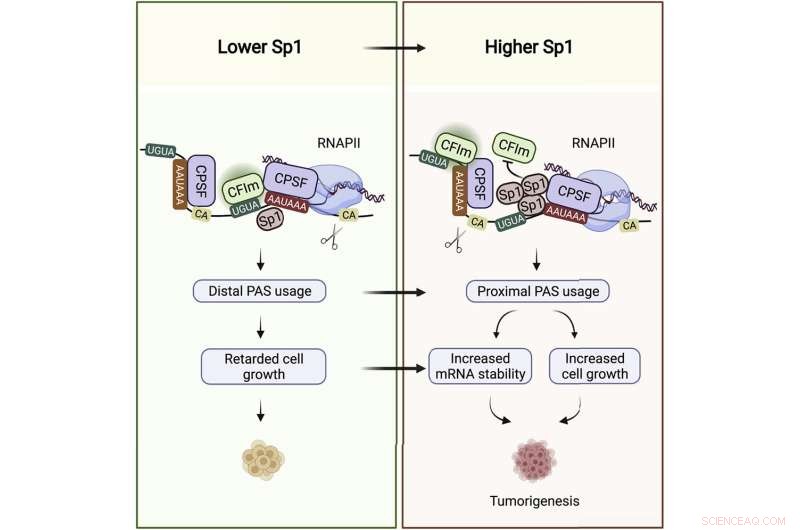
Grafisch abstract. Krediet:Moleculaire cel (2022). DOI:10.1016/j.molcel.2022.06.031
Al vier decennia lang wordt Specificity Protein 1 (Sp1) uitsluitend gebruikt als transcriptiefactor, een type eiwit dat DNA bindt en genen aanzet. Maar een onderzoek van het Donnelly Center heeft nu onthuld dat Sp1 een andere onverwachte rol speelt in genregulatie door de stabiliteit van de RNA-berichten van genen te beïnvloeden.
De bevinding is vooral belangrijk voor kankeronderzoek, omdat het het gevestigde denken over hoe Sp1 bijdraagt aan de ziekte op zijn kop zet en nieuwe wegen opent voor de ontwikkeling van behandelingen.
"Het is al lang bekend dat Sp1 betrokken is bij kanker, maar men dacht dat dit kwam door het vermogen om DNA te binden en als een transcriptiefactor te fungeren, omdat iedereen daarvan op de hoogte was", zegt Jack Greenblatt, senior auteur van het artikel. paper en een professor in moleculaire genetica in het Donnelly Center for Cellular and Biomolecular Research, aan de U of T's Temerty Faculty of Medicine.
"We denken dat dit niet het antwoord is. We denken dat het kanker aantast door zijn vermogen om RNA te binden en transcriptiestabiliteit te reguleren", zegt Greenblatt, die ook universiteitshoogleraar is.
Het tijdschrift Molecular Cell de bevindingen gepubliceerd.
Het onderzoek werpt onverwacht nieuw licht op een van de meest bestudeerde menselijke eiwitten. Sp1 werd bijna 40 jaar geleden voor het eerst geïdentificeerd als een DNA-bindende transcriptionele activator en was de eerste menselijke transcriptionele regulator die werd gezuiverd, zei Greenblatt. "Het is een standaardonderwerp in studieboeken voor niet-gegradueerden," voegde hij eraan toe.
Sp1 regelt de activering van ongeveer 6.000 genen - ongeveer een derde van het menselijk genoom - die meestal nodig zijn voor cellulaire voeding.
En nu is er ook de RNA-bindende Sp1, die de scepter zwaait over een andere en meestal niet-overlappende groep van 2000 genen door de overvloed van hun mRNA-kopieën te beïnvloeden, volgens de studie.
Wanneer een gen wordt ingeschakeld, wordt de code ervan gekopieerd naar een boodschapper-RNA, of een transcript, dat dient als een sjabloon voor het bouwen van het gecodeerde eiwitmolecuul. Aan zijn staarteinde herbergt mRNA het niet-vertaalde gebied, of UTR, dat niet wordt vertaald in eiwit, maar dat een regulerende rol heeft en belangrijk is voor transcriptstabiliteit. Onderzoek heeft aangetoond dat transcripten met lange UTR-staarten vaak minder stabiel zijn en sneller worden afgebroken door cellulaire enzymen, terwijl kortstaartige UTR's beter beschermd zijn tegen afbraak.
"Het is hier, in de UTR, dat Sp1 zijn doel-mRNA's bindt", zegt Syed Nabeel-Shah, een Ph.D. kandidaat in het laboratorium en de co-eerste auteur van het onderzoek, samen met voormalig Greenblatt laboratorium postdoctoraal onderzoeker, Jingwen Song. Toen Nabeel-Shah en Song Sp1 uit cellen verwijderden, ontdekten ze dat dit leidde tot een toename van de UTR-lengte van bepaalde transcripten, wat aangeeft dat Sp1 werkt om kortere UTR-staarten op te leveren. Ze toonden verder aan dat UTR-trimming wordt bereikt door de RNA-splitsingsmachinerie, die het RNA afsnijdt in de buurt van waar Sp1 is gebonden.
Controle van de UTR-lengte is naar voren gekomen als een belangrijke laag van genregulatie. Dit geldt met name voor kankercellen, die in overvloed aanwezig zijn in kortstaartige transcripten. Hoe korter de UTR-staart, hoe stabieler het mRNA voor veel transcripten, wat meer eiwittemplates betekent - en uiteindelijk meer eiwitmoleculen die kunnen worden geproduceerd.
"Snelgroeiende cellen hebben bepaalde genen nodig die op hogere niveaus tot expressie worden gebracht," zei Greenblatt. "Het effect van kortere UTR's is vaak een hogere mRNA-concentratie en bijgevolg een hogere eiwitconcentratie."
Het bleef echter onduidelijk hoe het evenwicht scheef staat in de richting van kortere UTR's in kankercellen. Maar Greenblatt en Nabeel-Shah denken dat Sp1 een deel van de sleutel is.
Het is al lang bekend dat Sp1-niveaus verhoogd zijn bij veel soorten kanker, waaronder borstkanker, waarop Nabeel-Shah en Song hun analyse richtten. Ze verkregen RNA-sequencinggegevens uit de Cancer Genome Atlas van duizend borstkankerpatiënten. Ze ontdekten dat Sp1-niveaus correleren met de lengte en abundantie van de doeltranscriptstaart. Hoe meer Sp1 in een patiëntmonster, hoe korter de UTR's in hetzelfde monster en hoe hoger de mRNA-niveaus wanneer die UTR's door Sp1 worden gebonden. "Dit alles suggereert dat Sp1 kanker bevordert door zijn RNA-bindende rol," zei Nabeel-Shah.
De bevinding is in tegenstelling tot de gevestigde opvatting dat Sp1 bijdraagt aan kanker door de expressie van zijn doelgenen als een DNA-bindend eiwit te stimuleren. Nabeel-Shah en Song vonden geen ondersteuning in de gegevens voor dit concept. Er was geen significante correlatie tussen Sp1-niveaus in borstkankercellen en de hoeveelheid mRNA die wordt getranscribeerd van de genen die het op DNA richt.
Hoewel ze alleen naar borstkanker keken, denken de onderzoekers dat Sp1 een vergelijkbare rol speelt bij andere soorten kanker, gezien het grote aantal mRNA's dat het reguleert.
De studie opent een nieuwe manier van denken, niet alleen over Sp1 en zijn rol bij kanker, maar ook over andere soortgelijke eiwitten. Sp1 behoort tot een familie van C2H2 zinkvingertranscriptiefactoren, die de grootste groep transcriptiefactoren bij mensen vormen. De meerderheid van de meer dan 700 leden blijft echter slecht verkend.
Het doel van het proefschrift van Nabeel-Shah is om te bepalen of veel andere C2H2-eiwitten ook RNA binden. Tot nu toe heeft hij 150 van deze eiwitten getest en ontdekt dat 145 zowel DNA als RNA binden, wat suggereert dat ook veel andere leden een dubbele rol kunnen spelen in genregulatie.
Sp1 was pas de eerste die werd ontdekt, net als vier decennia geleden. + Verder verkennen
Genexpressiemechanisme kan immuniteit hebben, implicaties voor kanker
 Strijkijzer uit printerafvaltoner trekken
Strijkijzer uit printerafvaltoner trekken De beste isolatoren om water warm te houden
De beste isolatoren om water warm te houden Bepaling van de parameters voor transmissie-elektronenmicroscopie
Bepaling van de parameters voor transmissie-elektronenmicroscopie Wetenschappers ontwikkelen nieuwe, goedkope tool voor het detecteren van bacteriën in voedsel en water
Wetenschappers ontwikkelen nieuwe, goedkope tool voor het detecteren van bacteriën in voedsel en water Onderzoeksteam vindt mogelijke nieuwe aanpak voor medicijnen tegen slaapziekte
Onderzoeksteam vindt mogelijke nieuwe aanpak voor medicijnen tegen slaapziekte
 Maanden van tevoren de moessonregen voorspellen met satellieten en simulaties
Maanden van tevoren de moessonregen voorspellen met satellieten en simulaties Het plantenleven breidt zich uit in de Everest-regio
Het plantenleven breidt zich uit in de Everest-regio Onderzoekers ontdekken dat door mensen veroorzaakte vervuiling de omgeving zelfs ondergronds verandert
Onderzoekers ontdekken dat door mensen veroorzaakte vervuiling de omgeving zelfs ondergronds verandert When Was the Rain Gauge Invented?
When Was the Rain Gauge Invented?  Hoe kunnen steden gezonder worden, groener, en rechtvaardiger in de toekomst?
Hoe kunnen steden gezonder worden, groener, en rechtvaardiger in de toekomst?
Hoofdlijnen
- Wat gebeurt er met planten en dierlijke cellen bij plaatsing in hypertonische, hypotone en isotone omgevingen?
- Wat is Embryo Cloning?
- 3D-verpakking van DNA reguleert celidentiteit
- Studie ontwikkelt nieuwe manier om kankercellen te identificeren
- Bodemverstoring vermindert de veerkracht van landerijen tegen klimaatverandering
- Oesterschelpen worden voor topprijzen verkocht terwijl biologen zich inspannen om schelpdierbanken te beschermen
- Kan gentherapie kaalheid genezen?
- Eiwitten in haaientanden kunnen duiden op wat ze eten
- Tropische insecten zijn extreem gevoelig voor veranderende klimaten
 Wat zijn de overeenkomsten tussen weer en klimaat?
Wat zijn de overeenkomsten tussen weer en klimaat?  Gouden en zilveren nano-snuisterijen
Gouden en zilveren nano-snuisterijen Laserstralen van antimaterie tot bestaan
Laserstralen van antimaterie tot bestaan NASA's planeetjacht TESS vangt een komeet voordat hij met wetenschap begint
NASA's planeetjacht TESS vangt een komeet voordat hij met wetenschap begint Kan warmte worden gecontroleerd als golven?
Kan warmte worden gecontroleerd als golven? Nieuwe 28-GHz transceiver maakt de weg vrij voor toekomstige 5G-apparaten
Nieuwe 28-GHz transceiver maakt de weg vrij voor toekomstige 5G-apparaten Hoe te converteren van gram naar liter met behulp van Density
Hoe te converteren van gram naar liter met behulp van Density  De koolstofbelasting in Zuid-Afrika is belangrijk voor de economie en de aanpak van klimaatverandering
De koolstofbelasting in Zuid-Afrika is belangrijk voor de economie en de aanpak van klimaatverandering
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com