
Wetenschap
DNA-enzym schudt celmembranen duizend keer sneller dan zijn natuurlijke tegenhanger
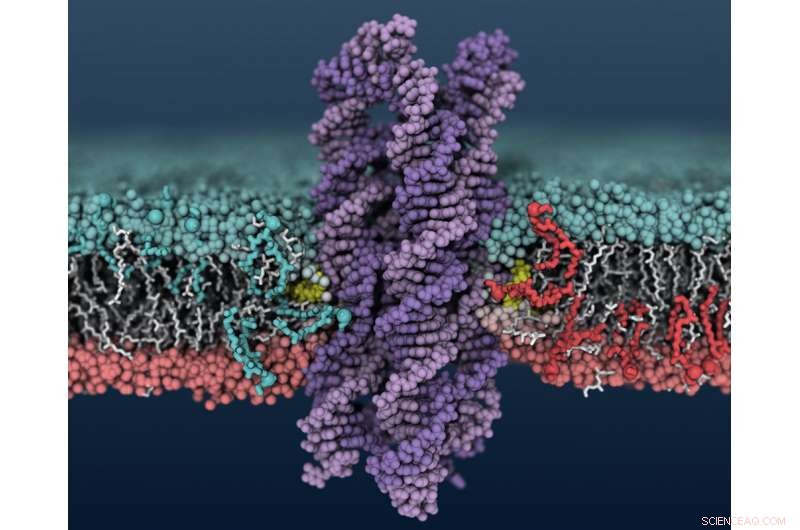
Een synthetisch DNA-enzym wordt ingebracht in een celmembraan, waardoor lipiden schuiven tussen de binnenste en buitenste membraanlagen. Krediet:Christopher Maffeo
Een nieuw synthetisch enzym, gemaakt van DNA in plaats van eiwit, flips lipide moleculen in het celmembraan, het triggeren van een signaalroute die kan worden gebruikt om celdood in kankercellen te induceren.
Onderzoekers van de Universiteit van Illinois in Urbana-Champaign en de Universiteit van Cambridge zeggen dat hun lipide-scrambling DNA-enzym het eerste in zijn klasse is dat beter presteert dan natuurlijk voorkomende enzymen - en doet dit met drie ordes van grootte. Ze publiceerden hun bevindingen in het tijdschrift Natuurcommunicatie .
"Celmembranen zijn aan de binnen- en buitenkant bekleed met een andere set moleculen, en cellen besteden veel middelen om dit in stand te houden, " zei studieleider Aleksei Aksimentiev, een professor in de natuurkunde in Illinois. "Maar op sommige momenten in het leven van een cel, de asymmetrie moet worden opgeheven. Dan worden de markeringen die binnen waren buiten, die signalen verzendt voor bepaalde processen, zoals celdood. Er zijn enzymen in de natuur die dat doen, scramblases genoemd. Echter, bij sommige ziekten waarbij scramblases onvoldoende zijn, dit gebeurt niet correct. Onze synthetische scramblase zou een weg kunnen zijn voor therapieën."
De groep van Aksimentiev ontdekte de scramblase-activiteit van DNA toen ze keken naar DNA-structuren die poriën en kanalen in celmembranen vormen. Ze gebruikten de Blue Waters-supercomputer van het National Center for Supercomputing Applications in Illinois om de systemen op atomair niveau te modelleren. Ze zagen dat wanneer bepaalde DNA-structuren in het membraan worden geplaatst – in dit geval een bundel van acht strengen DNA met cholesterol aan de uiteinden van twee van de strengen - lipiden in het membraan rond het DNA beginnen te schuifelen tussen de binnenste en buitenste membraanlagen.
Om de door de computermodellen voorspelde scramblase-activiteit te verifiëren, De groep van Aksimentiev in Illinois werkte samen met de groep van professor Ulrich Keyser in Cambridge. De Cambridge-groep synthetiseerde het DNA-enzym en testte het in modelmembraanbellen, blaasjes genoemd, en vervolgens in menselijke borstkankercellen.
"De resultaten laten zeer overtuigend zien dat onze DNA-nanostructuur inderdaad snelle lipidenverwisseling mogelijk maakt, " zei Alexander Ohmann, een afgestudeerde student aan Cambridge en een co-eerste auteur van het artikel samen met de afgestudeerde student Chen-Yu Li uit Illinois. "Het meest interessante, de hoge flipping-snelheid die wordt aangegeven door de moleculaire dynamica-simulaties lijkt in experimenten van dezelfde orde van grootte te zijn:tot duizend keer sneller dan wat eerder is aangetoond voor natuurlijke scramblases."
Op zichzelf, de DNA-scramblase produceert zonder onderscheid celdood, zei Aksimentiev. De volgende stap is om het te koppelen aan targetingsystemen die specifiek bepaalde celtypes zoeken, waarvan een aantal al zijn ontwikkeld voor andere DNA-agentia.
"We werken er ook aan om deze scramblase-structuren te activeren door licht of een andere stimulus, zodat ze alleen op aanvraag kunnen worden geactiveerd en kunnen worden uitgeschakeld, ' zei Aksimentiev.
"Hoewel we nog een lange weg te gaan hebben, dit werk benadrukt het enorme potentieel van synthetische DNA-nanostructuren met mogelijke toepassingen voor gepersonaliseerde medicijnen en therapieën voor een verscheidenheid aan gezondheidsproblemen in de toekomst, ' zei Ohmann.
 Keramische honingraatluchtfilters kunnen stadsvervuiling verminderen
Keramische honingraatluchtfilters kunnen stadsvervuiling verminderen Wetenschappers creëren synthetisch prototype dat in staat is om gesynchroniseerd te kloppen
Wetenschappers creëren synthetisch prototype dat in staat is om gesynchroniseerd te kloppen Een weg om defecten tijdens additive manufacturing te vermijden
Een weg om defecten tijdens additive manufacturing te vermijden Herbruikbare stoffen maskers blijven na een jaar wassen goed, drogen
Herbruikbare stoffen maskers blijven na een jaar wassen goed, drogen De synthese van de bacteriële celwand in realtime volgen
De synthese van de bacteriële celwand in realtime volgen
 Franse boeren blokkeren raffinaderijen vanwege import van palmolie
Franse boeren blokkeren raffinaderijen vanwege import van palmolie UTA breidt inspanningen uit om technologieën voor waterrecycling te ontwikkelen
UTA breidt inspanningen uit om technologieën voor waterrecycling te ontwikkelen Nieuw model voorspelt een toename van stofstormen in de VS
Nieuw model voorspelt een toename van stofstormen in de VS Luchtvervuiling in verband met gemiste miskramen in China:studie
Luchtvervuiling in verband met gemiste miskramen in China:studie Achteruitgang van het platteland niet gedreven door waterterugwinning
Achteruitgang van het platteland niet gedreven door waterterugwinning
Hoofdlijnen
- Welke genen en genomen onthullen over onze gezondheid
- Belang van aërobe celbeademing
- Onderzoekers ontdekten dat overmatige sociale interactie de collectieve respons verminderde
- Genetische redding bevordert het herstel van de met uitsterven bedreigde Australische dwergbuidelmuizen
- Valse oogvlekken intimideren roofdieren, onderzoekers vinden
- Hoe slapende listeria zich in cellen verbergt
- The Krebs Cycle Made Easy
- Caribische bidsprinkhanen hebben een oude Afrikaanse oorsprong
- Wanneer is de beste tijd van de dag om een beslissing te nemen?
- Hydrogels met periodiek patroon:een model voor coöperatieve vervorming
- We huwen wanorde met orde:de effecten van geometrische wanorde op vloeistoffen en vaste stoffen in mesoporeuze materialen

- Nieuwe katalysator produceert efficiënt waterstof uit zeewater

- Vormverschuivend materiaal kan morphen, keert zichzelf om met behulp van warmte, licht

- Op klei gebaseerde antimicrobiële verpakking houdt voedsel vers

 Moiré-roosters die worden gebruikt om de vorming van optische solitonen te induceren
Moiré-roosters die worden gebruikt om de vorming van optische solitonen te induceren Belang van toevoeging in kindergarten
Belang van toevoeging in kindergarten Ambitieus voelen maar economisch achtergelaten, voedt gevoelens van ontevredenheid met de overheid, studie vondsten
Ambitieus voelen maar economisch achtergelaten, voedt gevoelens van ontevredenheid met de overheid, studie vondsten Britse top 1 procent ontving een zesde van het inkomen van de natie vóór de crisis als gevolg van verborgen stijging van meerwaarden
Britse top 1 procent ontving een zesde van het inkomen van de natie vóór de crisis als gevolg van verborgen stijging van meerwaarden Onderzoekers vinden een manier om farmacoterrorisme te bestrijden
Onderzoekers vinden een manier om farmacoterrorisme te bestrijden Het verschil tussen metaconglomeraat en conglomeraat
Het verschil tussen metaconglomeraat en conglomeraat  Virtuele tests voor autonome rijsystemen
Virtuele tests voor autonome rijsystemen Van welke materialen zijn condensatorplaten gemaakt?
Van welke materialen zijn condensatorplaten gemaakt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

