
Wetenschap
Röntgenfoto's onthullen lay-out van geladen drugstransporter
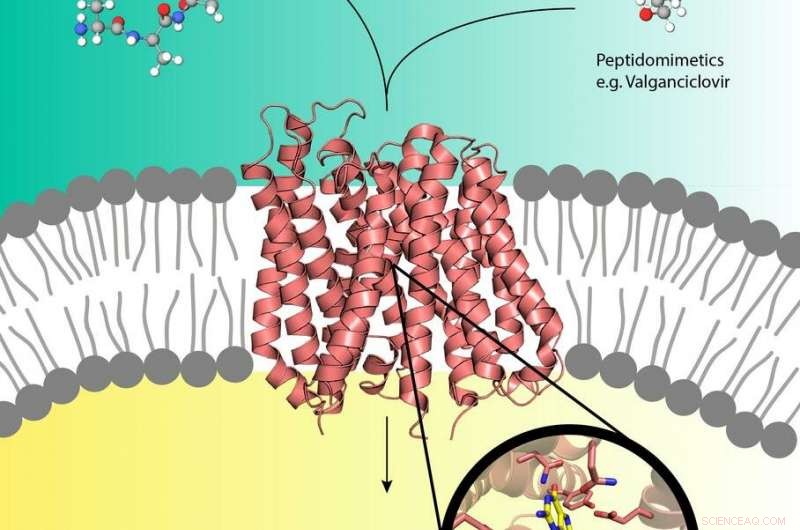
Pro-drugs zoals Valganciclovir (rechtsboven) kunnen de peptidetransporter (midden) in het celmembraan gebruiken die normaal gesproken voedingspeptiden (linksboven) de cel in transporteert. Krediet:EMBL, Yonca Oeral-Blimke
Experimenten bij DESY's röntgenbron PETRA III hebben de eerste structuur onthuld van een biologisch transporteiwit geladen met een pro-drug. Prodrugs zijn inactieve medicijnen die worden gemetaboliseerd tot een actieve, functionele vorm in het lichaam. Ze kunnen de menselijke nutriëntentransporteiwitten PepT1 of PepT2 kapen die zich in het celmembraan bevinden en gewoonlijk peptiden afkomstig van verteerd voedsel naar cellen leiden. Op deze manier, pro-drugs kunnen rechtstreeks de cel in liften, het versnellen van de absorptie van het medicijn. Hoewel het pro-drug-concept zeer effectief is, er is op moleculair niveau weinig bekend over de structuur van de peptidetransporters en hoe ze herkennen, binden en transporteren pro-drugs. De groepen van Christian Loew en Jan Kosinski van het European Molecular Biology Laboratory (EMBL) die werkzaam zijn bij het Center for Structural Systems Biology (CSSB) op de DESY-campus in Hamburg, zijn nu een stap dichter bij het begrijpen hiervan.
De wetenschappers bepaalden de eerste kristalstructuur met hoge resolutie van een peptidetransporter in complex met de farmacologisch relevante pro-drug valganciclovir; een medicijn dat bepaalde virale infecties bestrijdt. hun resultaten, gepubliceerd in de Tijdschrift van de American Chemical Society , zou kunnen helpen bij het ontwerpen van pro-drugs met verbeterde absorptiesnelheden. CSSB is een samenwerkingsverband van tien wetenschappelijke instellingen waaronder DESY.
De bacteriële peptidetransporter DtpA van Escherichia coli is een nauwe homoloog van de menselijke PepT1-transporter en werd daarom door de wetenschappers gekozen als prototype. De ruimtelijke structuur van een biomolecuul kan worden bepaald door kleine kristallen te kweken uit veel van dezelfde biomoleculen en deze te belichten met röntgenstraling. De kristallen breken de röntgenstralen af op een manier die verband houdt met hun innerlijke structuur. Dit betekent, van het diffractiepatroon, de binnenstructuur van het kristal kan worden berekend, het onthullen van de atomaire structuur van zijn bestanddelen, de biomoleculen.
Het kweken van voldoende hoogwaardige kristallen uit biomoleculen kan een hele uitdaging zijn. Om goed brekende kristallen van DtpA te produceren, Loew werkte samen met de groep van Jan Steyaert van de Vrije Universiteit in Brussel om DtpA-specifieke nanobodies te genereren. Nanobodies zijn specifieke antilichaamfragmenten met een enkel domein. "Ze verhogen de stabiliteit van membranen, eiwitten zoals DtpA, waardoor we hoogwaardige kristallen kunnen genereren, " legt Loew uit.
De Loew-groep voerde vervolgens de kristallisatie-experimenten uit van DtpA in complex met een nanobody en een pro-drugmolecuul in de Sample Preparation and Characterization-faciliteit (SPC) en analyseerde de verkregen kristallen op de bundellijnen P13 en P14 die deel uitmaken van DESY's X- lichtbron PETRA III en geëxploiteerd door t EMBL. De wetenschappers waren in staat om een resolutie van 2,65 Ångstrom (0,265 nanometer) te bepalen van DtpA gebonden met de pro-drug valganciclovir die een onverwachte bindingsmodus onthulde. "De oriëntatie van de pro-drug in de bindingszak is 180 graden omgedraaid ten opzichte van eerdere voorspellingen, " legt Loew uit. "We hebben ook ontdekt dat DtpA bij voorkeur tripeptiden bindt en waarschijnlijk transporteert over dipeptiden."
De Kosinski-groep bouwde een hoogwaardig structureel model van de menselijke PepT1-transporter in complex met valganciclovir met behulp van de DtpA-kristalstructuur als richtlijn. "Het model laat zien dat humaan PepT1 het medicijn zeer waarschijnlijk op dezelfde manier bindt als DtpA en lokaliseert de exacte aminozuurgroepen die verantwoordelijk zijn voor binding, " verduidelijkt Kosinski. Daarom, de inzichten die door dit model van PepT1 worden gegenereerd, kunnen de ontwikkeling van nieuwe pro-drugs met verbeterde absorptiesnelheden vergemakkelijken. Dergelijke verbeteringen zouden niet alleen de farmacologisch effectieve dosis verlagen, maar zouden ook de door patiënten ervaren negatieve bijwerkingen kunnen verminderen.
 Wetenschappers werken aan biologisch afbreekbaar plastic van zonlicht
Wetenschappers werken aan biologisch afbreekbaar plastic van zonlicht Machine learning gaat dieper in op katalysatorinteracties om de ontwikkeling van materialen te versnellen
Machine learning gaat dieper in op katalysatorinteracties om de ontwikkeling van materialen te versnellen Verschil tussen natriumcarbonaat en calciumcarbonaat
Verschil tussen natriumcarbonaat en calciumcarbonaat  Gereedschappen en apparatuur gebruikt voor de pluimveehouderij
Gereedschappen en apparatuur gebruikt voor de pluimveehouderij Het toepassen van computationele chemie om realistische chemische processen te simuleren
Het toepassen van computationele chemie om realistische chemische processen te simuleren
 Extreem weer meemaken is niet genoeg om klimaatkanssceptici te overtuigen
Extreem weer meemaken is niet genoeg om klimaatkanssceptici te overtuigen Onderzoekers documenteren wijdverbreid methaan dat voor de kust van Oregon sijpelt
Onderzoekers documenteren wijdverbreid methaan dat voor de kust van Oregon sijpelt Nematoden begrijpen om klimaatverandering aan te pakken
Nematoden begrijpen om klimaatverandering aan te pakken Everglades heeft meer zoet water nodig om het binnendringen van zout water te bestrijden
Everglades heeft meer zoet water nodig om het binnendringen van zout water te bestrijden Studie ondersteunt theorie van warmtebron onder Antarctica
Studie ondersteunt theorie van warmtebron onder Antarctica
Hoofdlijnen
- Plantaanpassingen: woestijn, tropisch regenwoud, toendra
- Waarom zijn we gewelddadig?
- Economen ontwikkelen besluitvormingsmethode voor beheer van koraalduivels
- Het belang van het bestuderen van menselijke DNA-genetica
- Genotypes bepalen
- Hoe maak je een dierencel uit Candy
- Genetisch verhogen van de voedingswaarde van maïs kan miljoenen ten goede komen
- Zou het hebben van een eigen kloon hetzelfde zijn als het hebben van een identieke tweeling?
- Herenbaarden dragen meer bacteriën dan hondenbont,
- Kristalstructuurvoorspelling van willekeurige legering met meerdere elementen
- Baanbrekende chemiebenadering kan leiden tot robuustere zachte elektronica

- Recordbrekende nieuwe analytische methode voor het vingerafdrukken van aardolie en andere complexe mengsels

- De eerste in zijn soort chemische oscillator biedt een nieuw niveau van moleculaire controle

- Een biomassa-naar-vloeistoffabriek voor de productie van duurzame synthetische brandstof

 Meer uit microben halen - Shewanella bestuderen in microzwaartekracht
Meer uit microben halen - Shewanella bestuderen in microzwaartekracht Wat de Cassinis-missie onthulde over de bekende en nieuw ontdekte manen van Saturnus
Wat de Cassinis-missie onthulde over de bekende en nieuw ontdekte manen van Saturnus Kunt u geen Romeinse cijfers lezen? Wij kunnen het je leren
Kunt u geen Romeinse cijfers lezen? Wij kunnen het je leren  Airbus noemt Guillaume Faury en vervangt Enders
Airbus noemt Guillaume Faury en vervangt Enders Verschil tussen wet en principe in de natuurkunde
Verschil tussen wet en principe in de natuurkunde  Squishy hydrogels kunnen het ticket zijn voor het bestuderen van biologische effecten van nanodeeltjes
Squishy hydrogels kunnen het ticket zijn voor het bestuderen van biologische effecten van nanodeeltjes 40-jarige controverse in vaste-stoffysica opgelost
40-jarige controverse in vaste-stoffysica opgelost Wetenschappers kweken supervoedzame gewassen om honger in de wereld te helpen oplossen
Wetenschappers kweken supervoedzame gewassen om honger in de wereld te helpen oplossen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Norway | Swedish |

-
Wetenschap © https://nl.scienceaq.com

