
Wetenschap
Alzheimerziekte zorgt ervoor dat cellen oververhit raken en bakken als eieren
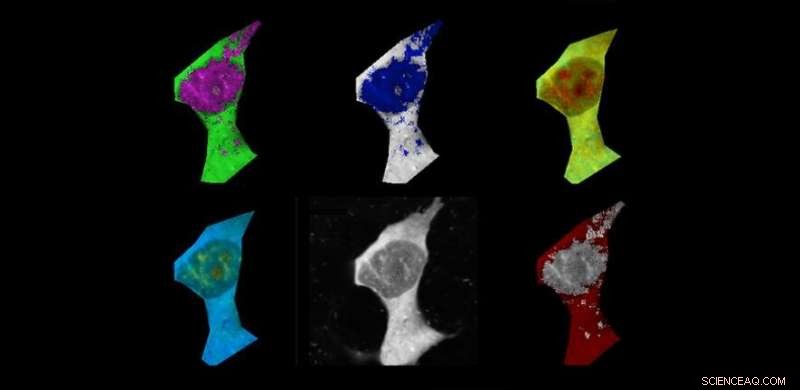
Zoogdiercel gekleurd met polymere fluorescentiethermometers en vals gekleurd op basis van temperatuurgradiënten. Krediet:Chyi Wei Chung
Onderzoekers hebben aangetoond dat aggregatie van amyloïde-bèta, een van de twee belangrijkste eiwitten die betrokken zijn bij de ziekte van Alzheimer, ervoor zorgt dat cellen oververhit raken en "bakken als eieren".
De onderzoekers van de Universiteit van Cambridge gebruikten sensoren die klein en gevoelig genoeg waren om temperatuurveranderingen in individuele cellen te detecteren, en ontdekten dat als amyloïde-bèta zich misvouwt en samenklontert, dit ervoor zorgt dat cellen oververhit raken.
In een experiment met menselijke cellijnen ontdekten de onderzoekers dat de warmte die vrijkomt door amyloïde-bèta-aggregatie mogelijk andere, gezonde amyloïde-bèta kan doen aggregeren, waardoor er steeds meer aggregaten worden gevormd.
In dezelfde reeks experimenten toonden de onderzoekers ook aan dat amyloïde-bèta-aggregatie kan worden gestopt en de celtemperatuur kan worden verlaagd, door toevoeging van een medicijnverbinding. De experimenten suggereren ook dat de verbinding potentieel heeft als therapeutisch middel voor de ziekte van Alzheimer, hoewel eerst uitgebreide tests en klinische proeven nodig zouden zijn.
De onderzoekers zeggen dat hun test kan worden gebruikt als een diagnostisch hulpmiddel voor de ziekte van Alzheimer, of om potentiële kandidaat-geneesmiddelen te screenen. De resultaten worden gerapporteerd in het Journal of the American Chemical Society .
De ziekte van Alzheimer treft naar schatting 44 miljoen mensen wereldwijd en er zijn momenteel geen effectieve diagnostiek of behandelingen. Bij de ziekte van Alzheimer bouwen amyloïde-bèta en een ander eiwit, tau genaamd, zich op in klitten en plaques - gezamenlijk bekend als aggregaten - waardoor hersencellen afsterven en de hersenen krimpen. Dit resulteert in geheugenverlies, persoonlijkheidsveranderingen en moeilijkheden bij het uitvoeren van dagelijkse functies.
Het is een moeilijke ziekte om te bestuderen, omdat het zich over tientallen jaren ontwikkelt, en een definitieve diagnose kan alleen worden gegeven na onderzoek van hersenweefsel na de dood. Het is nog steeds niet bekend wat voor soort biochemische veranderingen in een cel leiden tot amyloïde-bèta-aggregatie.
In de onderzoeksgroep van professor Gabriele Kaminski Schierle bij Cambridge's Department of Chemical Engineering and Biotechnology hebben ze het mogelijke verband onderzocht tussen temperatuur en amyloïde-bèta-aggregatie in menselijke cellen.
Het gebied van het bestuderen van temperatuurveranderingen in een cel staat bekend als intracellulaire thermogenese. Het is een nieuw en uitdagend veld:wetenschappers hebben sensoren ontwikkeld waarmee temperatuurveranderingen kunnen worden gemeten, maar niemand heeft ooit geprobeerd deze sensoren te gebruiken om aandoeningen zoals de ziekte van Alzheimer te bestuderen.
"Thermogenese is in verband gebracht met cellulaire stress, wat verdere aggregatie kan bevorderen", zegt Chyi Wei Chung, de eerste auteur van het onderzoek. "Wij zijn van mening dat wanneer er een onbalans in cellen is, zoals wanneer de amyloïde-bèta-concentratie iets te hoog is en het begint te accumuleren, de celtemperatuur stijgt."
"Oververhitting van een cel is als het bakken van een ei - als het opwarmt, beginnen de eiwitten samen te klonteren en worden ze niet-functioneel", zegt Kaminski Schierle, die het onderzoek leidde.
De onderzoekers gebruikten kleine temperatuursensoren, fluorescente polymere thermometers (FTP's) genaamd, om het verband tussen aggregatie en temperatuur te bestuderen. Ze voegden amyloïde-bèta toe aan menselijke cellijnen om het aggregatieproces op gang te brengen en gebruikten een chemische stof genaamd FCCP als controle, omdat bekend is dat het een temperatuurstijging veroorzaakt.
Ze ontdekten dat toen amyloïde-bèta draadachtige aggregaten begon te vormen, fibrillen genaamd, de gemiddelde temperatuur van de cellen begon te stijgen. De stijging van de celtemperatuur was significant in vergelijking met cellen waaraan geen amyloïde-bèta was toegevoegd.
"Als de fibrillen beginnen uit te rekken, geven ze energie af in de vorm van warmte", zegt Kaminski Schierle. "Aggregatie van amyloïde-bèta vereist nogal wat energie om op gang te komen, maar zodra het aggregatieproces begint, versnelt het en komt er meer warmte vrij, waardoor er meer aggregaten kunnen worden gevormd."
"Zodra de aggregaten zijn gevormd, kunnen ze de cel verlaten en worden opgenomen door aangrenzende cellen, waardoor ze gezond amyloïde-bèta in die cellen infecteren", zei Chung. "Niemand heeft eerder dit verband aangetoond tussen temperatuur en aggregatie in levende cellen."
Met behulp van een medicijn dat de amyloïde-bèta-aggregatie remt, konden de onderzoekers de fibrillen aanwijzen als de oorzaak van thermogenese. Het was voorheen onbekend of eiwitaggregatie of mogelijke schade aan mitochondriën - de 'batterijen' die cellen aandrijven - verantwoordelijk was voor dit fenomeen.
De onderzoekers ontdekten ook dat de stijging van de cellulaire temperaturen kon worden verzacht door ze te behandelen met een aggregatieremmer, wat het potentieel ervan als therapeutisch middel voor de ziekte van Alzheimer benadrukt.
De laboratoriumexperimenten werden aangevuld met computationele modellering die beschrijft wat er zou kunnen gebeuren met amyloïde-bèta in een intracellulaire omgeving en waarom dit zou kunnen leiden tot een verhoging van de intracellulaire temperaturen. De onderzoekers hopen dat hun werk nieuwe studies zal motiveren met verschillende parameters van fysiologische relevantie. + Verder verkennen
De ziekte van Alzheimer kan beginnen in zenuwcellen
 Onderzoekers bouwen robotwetenschapper die al een nieuwe katalysator heeft ontdekt
Onderzoekers bouwen robotwetenschapper die al een nieuwe katalysator heeft ontdekt Algemene kenmerken van zuren en basen
Algemene kenmerken van zuren en basen  Hoe Molarity te berekenen uit een titratiecurve
Hoe Molarity te berekenen uit een titratiecurve  Apparaat dat moleculaire techniek gebruikt, kan ultragevoelige, geautomatiseerd systeem om virussen te detecteren, ziekte
Apparaat dat moleculaire techniek gebruikt, kan ultragevoelige, geautomatiseerd systeem om virussen te detecteren, ziekte Nieuwe methode benchmarkt organische gemengde geleiders
Nieuwe methode benchmarkt organische gemengde geleiders
Hoofdlijnen
- Koralen kunnen tijdens hun leven verworven mutaties doorgeven aan nakomelingen
- Onkruidverdelger glyfosaat, controversieel maar nog steeds het meest gebruikt
- Wat gebeurt er met je cellen als je uitgedroogd bent?
- Ja,
- Snelle papegaaien gefokt op roofdiervrije eilanden die met uitsterven worden bedreigd
- Kunnen we onze organen klonen voor gebruik bij een transplantatie?
- Sarcodina Life Cycle
- Hoe werkt ureum denaturisch?
- Nieuwe aanwijzingen uit hersenstructuren van bidsprinkhaangarnalen
- Krachtige röntgenstralen ontsluiten geheimen van kristalvorming op nanoschaal

- Multimodale beeldvorming toont aan dat spanning de chemie in een fotovoltaïsch materiaal kan stimuleren

- Nieuw type triterpenen ontdekt
- Onderzoekers maken doorbraak in antioxidant-enzym gekoppeld aan geelzucht
- Gevoelige nieuwe test detecteert antilichamen tegen SARS-CoV-2 in slechts 10 minuten

 Vulkaan die as spuwt, heet grind op het Caribische eiland St Vincent (update)
Vulkaan die as spuwt, heet grind op het Caribische eiland St Vincent (update) Mooie groene airglow gespot door aurora-jagers - maar wat is het?
Mooie groene airglow gespot door aurora-jagers - maar wat is het? Sedimenten analyseren om de opwarming van de aarde 56 miljoen jaar geleden te onderzoeken
Sedimenten analyseren om de opwarming van de aarde 56 miljoen jaar geleden te onderzoeken Tijd die ouders met kinderen doorbrengen, de sleutel tot academisch succes
Tijd die ouders met kinderen doorbrengen, de sleutel tot academisch succes Zijn de kleinkinderen het waard? Het beleid inzake klimaatverandering hangt af van hoe we de menselijke bevolking waarderen
Zijn de kleinkinderen het waard? Het beleid inzake klimaatverandering hangt af van hoe we de menselijke bevolking waarderen Wat zit er in je tarwe? Wetenschappers voegen het genoom van de meest voorkomende broodtarwe samen
Wat zit er in je tarwe? Wetenschappers voegen het genoom van de meest voorkomende broodtarwe samen Niet zo kostbaar:het strippen van goud van AFM-sondes maakt een betere meting van picoschaalkrachten mogelijk
Niet zo kostbaar:het strippen van goud van AFM-sondes maakt een betere meting van picoschaalkrachten mogelijk China ziet 20-25 juli lancering voor Mars rover
China ziet 20-25 juli lancering voor Mars rover
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

