
Wetenschap
Onderzoekers maken doorbraak in antioxidant-enzym gekoppeld aan geelzucht
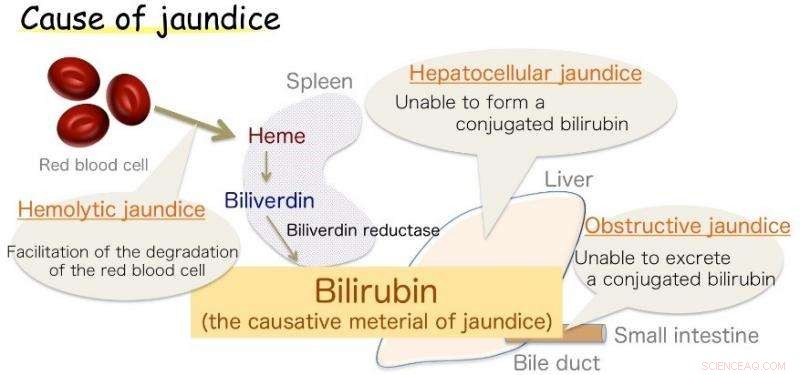
Afb.1:Oorzaak van geelzucht. Bilirubine is de veroorzaker van geelzucht. Krediet:Universiteit van Osaka
Een Japans onderzoeksteam waarbij de Universiteit van Osaka betrokken was, onderzocht biliverdine-reductase, het enzym dat bilirubine produceert – een stof die verband houdt met geelzucht – uit biliverdine (BV). Er werden twee BV-moleculen gevonden op de enzymreactieplaats, in een ongebruikelijke gestapelde opstelling. Mutatie-experimenten bevestigden welk enzymaminozuur nodig was voor de productie van bilirubine. In het voorgestelde mechanisme dit aminozuur brengt waterstof over naar één BV-molecuul, de andere BV als kanaal gebruiken. Dit helpt bij het zoeken naar medicijnen tegen geelzucht.
Osaka – Geelzucht, gekenmerkt door geelverkleuring van de huid, komt vaak voor bij zuigelingen, maar ook een symptoom van verschillende volwassen ziekten. Deze verkleuring wordt veroorzaakt door een teveel aan bilirubine (BR), de stof die gal zijn gele tint geeft. Echter, BR is ook een essentiële antioxidant, die op gezonde niveaus cellen beschermt tegen peroxideschade. De productie ervan in het lichaam, Hoewel, lange tijd een bron van onzekerheid geweest.
Nutsvoorzieningen, een Japanse onderzoekssamenwerking waarbij de universiteit van Osaka betrokken is, denkt het antwoord te hebben. Van BR is al bekend dat het wordt geproduceerd uit een verwante chemische stof, biliverdine (BV), door het enzym biliverdine-reductase (BVR). Het enzym wikkelt zich rond BV en brengt twee waterstofatomen over - een positieve en een negatieve - om de gele antioxidant te produceren. Echter, biologen konden niet vaststellen welk deel van het enzym chemisch bij het proces betrokken was (de actieve plaats), of waar de positieve waterstof vandaan kwam. De bevindingen werden onlangs gerapporteerd in Natuurcommunicatie .
"Eerdere studies gebruikten BVR van ratten, en zou het enzym nooit goed genoeg kunnen kristalliseren om te bepalen hoe het aan BV bindt, " studie co-auteur Keiichi Fukuyama zegt. "We realiseerden ons dat hetzelfde enzym in Synechocystis-bacteriën een bijna identieke vouwvorm had, maar was gemakkelijker te onderzoeken met röntgenkristallografie."
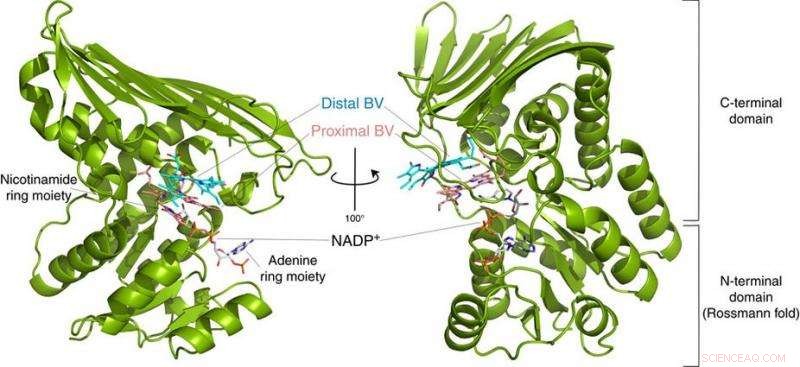
Fig.2:Structuur van BVR. Deze structuur onthulde dat BVR twee biliverdine-substraten (Distal BV en Proximal BV) tegelijkertijd bindt. Krediet:Universiteit van Osaka
Tot hun verbazing, de onderzoekers vonden twee moleculen van BV - de ene op de andere gestapeld - op de actieve plaats, ook al is er maar één geconverteerd naar BR. Uit de röntgengegevens, ze afgeleid waarom er twee nodig waren. De eerste BV, vanwege de richting waarin het de negatieve waterstof ontvangt, kan de positieve waterstof niet direct van het enzym accepteren. In plaats daarvan, de tweede BV fungeert als waterstofleiding om het proces mogelijk te maken, maar wordt zelf niet omgezet in BR.
Van de structuur, de onderzoekers stelden voor welke van de 328 aminozuren van het enzym daadwerkelijk het positieve waterstofatoom levert. Vervolgens, ze voerden experimenten uit waarbij de enzymen werden gemuteerd om specifiek dat aminozuur te verwijderen, terwijl de anderen intact blijven. De resulterende enzymen, of het nu gaat om bacteriën, ratten, of mensen, waren vrijwel niet in staat om BR te produceren. Verdere experimenten bevestigden dat de enzymen van ratten en mensen ook twee BV-moleculen gebruikten, net als de bacteriën.
"Zo'n keurige stapeling van twee substraatmoleculen tijdens enzymatische processen is zeer zeldzaam, ", zegt Fukuyama. "Een beter begrip van BR-productie is niet alleen opwindend voor de biochemie, maar zou ons moeten helpen medicijnen te ontwikkelen voor ziekten die worden gekenmerkt door ernstige geelzucht door overmatige BR, zoals hepatitis."
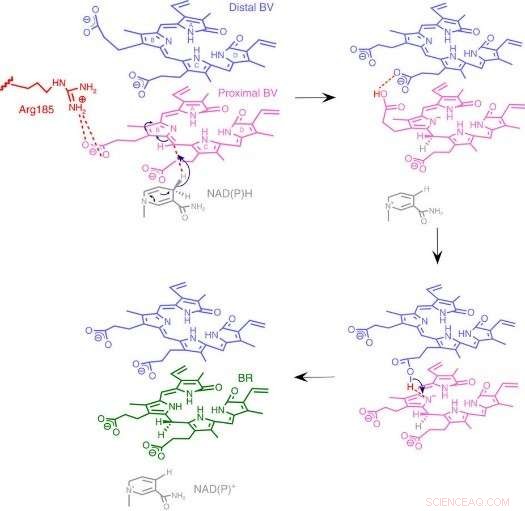
Fig.3:Mechanisme van de BVR-reactie. We stellen een uniek reactiemechanisme voor gebaseerd op een nieuwe enzymstructuur waarin twee gestapelde substraten aan één katalytische pocket binden. Krediet:Universiteit van Osaka
 "White Spiders in Florida
"White Spiders in Florida De effecten van menselijke activiteit op de koolstofcyclus
De effecten van menselijke activiteit op de koolstofcyclus
De koolstofcyclus is een van de vele biogeochemische cycli waarmee de verschillende verbindingen die nodig zijn voor het leven, zoals water, stikstof, zwavel, koolstof en fosfor, continu wo
 Ren naar de heuvels:Tsunami-angst veroorzaakt chaos in Indonesische stad
Ren naar de heuvels:Tsunami-angst veroorzaakt chaos in Indonesische stad Pandemische rijreducties zullen de uitstoot van broeikasgassen niet veel verminderen
Pandemische rijreducties zullen de uitstoot van broeikasgassen niet veel verminderen Nieuwe kaart voor radioactieve bodemverontreiniging in West-Europa
Nieuwe kaart voor radioactieve bodemverontreiniging in West-Europa
Hoofdlijnen
- Waarom kunnen we ons niet herinneren dat we baby's waren?
- Verschillen tussen gisten en vormpjes
- Is alle pijn mentaal?
- Bevindingen sonde cel samenwerking, massale migratie
- Law of Independent Assortment (Mendel): definitie, verklaring, voorbeeld
- Inheemse vissoorten lopen gevaar na verwijdering van water uit de Colorado-rivier
- Geneesmiddelresistentie uit schimmels verdrijven
- The Stages of the Human Decomposition Process
- Lijst van aseksueel reproducerende organismen
- Onderzoekers leggen in realtime rondzwervende moleculaire fragmenten vast

- Hoge druk creëert nieuwe buren voor beryllium
- Samenwerking leidt tot ontdekking van 2D-polymeer
- Hoe moleculaire formule te vinden van empirische formule

- Mangaan kan eindelijk het katalysatorprobleem van waterstofbrandstofcellen oplossen
 Milieuvernuft:deze creatieve zakelijke ideeën zijn bedoeld om zowel duurzaam als succesvol te zijn
Milieuvernuft:deze creatieve zakelijke ideeën zijn bedoeld om zowel duurzaam als succesvol te zijn De gebroken spiegel:kan pariteitsschending in moleculen eindelijk worden gemeten?
De gebroken spiegel:kan pariteitsschending in moleculen eindelijk worden gemeten? Hoe lineaire vergelijkingen te schrijven in Algebra
Hoe lineaire vergelijkingen te schrijven in Algebra  Ontdekking van een heilige graal met de uitvinding van universeel computergeheugen
Ontdekking van een heilige graal met de uitvinding van universeel computergeheugen Europa staat voor nieuwe ruimte-uitdagingen
Europa staat voor nieuwe ruimte-uitdagingen Paul Berg
Paul Berg  Eerste grootschalige studie belicht kunstenaarsdiversiteit in Amerikaanse musea
Eerste grootschalige studie belicht kunstenaarsdiversiteit in Amerikaanse musea Bosbranden nemen toe als studie waarschuwt voor gevaar voor luchtkwaliteit
Bosbranden nemen toe als studie waarschuwt voor gevaar voor luchtkwaliteit
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

